
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A. 由于碳酸的酸性弱于HA,充入CO2不能生成HA,因此充入CO2并不能增强抑菌能力
B. pH相同的NaA和NaHCO3溶液,导电能力前者强于后者
C. 当pH为5.0时,饮料中![]() =0.16
=0.16
D. 碳酸饮料中各种粒子的浓度关系为:c(H+) +c(Na+)=c(HCO![]() )+2c(CO
)+2c(CO![]() )+c(OH-)+c(A-)
)+c(OH-)+c(A-)
【答案】A
【解析】
A,NaA在溶液中存在水解平衡A-+H2O![]() HA+OH-,加压充入CO2平衡正向移动,HA浓度增大,HA的抑菌能力显著高于A-,充入CO2能增强抑菌能力,A项错误;B,由于Ka(HA)
HA+OH-,加压充入CO2平衡正向移动,HA浓度增大,HA的抑菌能力显著高于A-,充入CO2能增强抑菌能力,A项错误;B,由于Ka(HA)![]() Ka1(H2CO3),则A-的水解能力小于HCO3-,等pH的NaA物质的量浓度大于NaHCO3,等pH的NaA溶液中离子物质的量浓度大于NaHCO3,导电能力NaA大于NaHCO3,B项正确;C,HA的电离方程式为HA
Ka1(H2CO3),则A-的水解能力小于HCO3-,等pH的NaA物质的量浓度大于NaHCO3,等pH的NaA溶液中离子物质的量浓度大于NaHCO3,导电能力NaA大于NaHCO3,B项正确;C,HA的电离方程式为HA![]() H++A-,Ka(HA)=
H++A-,Ka(HA)=![]() ,
,![]() =
=![]() =
=![]() =0.16,C项正确;D,碳酸饮料中的电荷守恒为c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(A-)+c(OH-),D项正确;答案选A。
=0.16,C项正确;D,碳酸饮料中的电荷守恒为c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(A-)+c(OH-),D项正确;答案选A。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行。如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
A.计算机芯片的组成元素位于第14纵行
B.第10纵行元素全部是金属元素
C.第18纵行元素单质全部是气体
D.只有第2纵行元素的原子最外层有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )
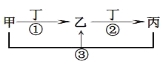
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计,能达到实验目的的是
A.用乙醇萃取溴水中的溴单质
B.用分液漏斗从食醋中分离出乙酸
C.用蒸馏的方法从工业酒精中提取乙醇
D.将食盐水降温结晶获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中一种为金属元素。m、n、p、q、r、s是由这些元素组成的二元或三元化合物,t是元素Y的常见单质,m 是一种具有特殊颜色的气体,p 可作漂白剂、供氧剂。上述物质的转化关系如图所示。下列说法中不正确的( )
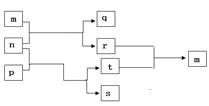
A. 四种元素简单离子半径:X〉Y〉Z〉W
B. p、s中的化学键类型完全相同
C. X、Y的简单氢化物的沸点:Y〉X
D. 常温下,0.01mol/L q溶液的pH为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
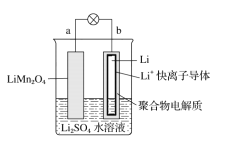
A. a为电池的正极
B. 电池充电反应为![]()
C. 放电时,a极锂的化合价发生变化
D. 放电时,溶液中Li+从b向a迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com