
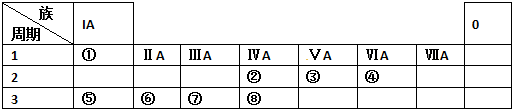
| A. | ①③⑤ | B. | ②④⑦ | C. | ②⑤⑧ | D. | 全部正确 |
分析 ①酸中含几个H原子,不一定是几元酸;
②由两种或以上的物质构成的为混合物;
③最外层电子数少的不一定是金属元素.
④SiO2只能与酸中的氢氟酸反应,与其它的强酸不反应.
⑤分散质粒子直径介于1-100nm之间的分散系为胶体;
⑥非金属元素的原子间形成的大多数为共价键.
⑦在水溶液中或熔融状态下能导电的化合物为电解质.
⑧族序数等于其周期序数的元素有H、Be、Al等元素.
解答 解:①酸中含几个H原子,不一定是几元酸,而是根据酸能电离出几个氢离子则为几元酸,故①错误;
②由两种或以上的物质构成的为混合物,铝热剂是金属铝和某些金属氧化物的混合物、福尔马林是甲醛的水溶液、水玻璃是硅酸钠的水溶液、漂白粉是氯化钙和次氯酸钙的混合物,故均为混合物,故②正确;
③最外层电子数少的不一定是金属元素,如H元素,最外层电子只有一个,但为非金属元素,故③错误;
④SiO2只能与酸中的氢氟酸反应,与其它的强酸不反应,故不是两性氧化物,是酸性氧化物,故④正确;
⑤分散质粒子直径介于1-100nm之间的分散系为胶体,故胶粒的直径介于1-100nm之间,故⑤错误;
⑥非金属元素的原子间形成的大多数为共价键,但不全为共价键,如NH4Cl中的N元素和Cl元素之间为离子键,故⑥错误;
⑦在水溶液中或熔融状态下能导电的化合物为电解质,包括全部的离子化合物和部分共价化合物,H2O、HCl、NH3•H2O在水溶液中能导电,Al2O3、Pb(CH3COO)2在熔融状态下能导电,故均为电解质,故⑦正确;
⑧族序数等于其周期序数的元素有H、Be、Al等元素,而H元素为非金属元素,故⑧错误.
故选B.
点评 本题系统的考查了酸的分类、混合物的概念以及酸性氧化物的辨析等,考查了知识非常全面,综合性较强,但难度不大,注意加强基础的掌握.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 电路中流过0.05mol电子 | B. | 溶液中c(Cu2+)降低 | ||
| C. | 电解质溶液质量减少 | D. | 阳极铜消耗了1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg与Cl2完全反应,失去电子的数目为0.2NA | |
| B. | 标准状况下,NA个SO3分子所占的体积约为22.4L | |
| C. | 1mol Cl2与H2完全反应,转移的电子数目为NA | |
| D. | CO2的摩尔质量等于NA个CO2分子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2发生氧化反应 | |
| B. | 氧化性:Cr2O72->Fe3+>SO42- | |
| C. | 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA | |
| D. | 若6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸在该反应中起酸性和氧化性作用 | |
| B. | 生成0.5molSe,转移电子数为2NA | |
| C. | I2是氧化产物 | |
| D. | 氧化剂和还原剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用四氯化碳萃取碘单质,静置,上层显示紫红色 | |
| B. | 坩埚需要垫石棉网加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| D. | 蒸发时用玻璃棒和向容量瓶移液时用玻璃棒用途不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com