
某元素R的二价阴离子核外共有a个电子,核内有b个中子,则R原子的符号应表示为: 。
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
元素周期表是人们研究物质性质的重要工具,下表是元素周期表的一部分,请用化学用语回答下列问题: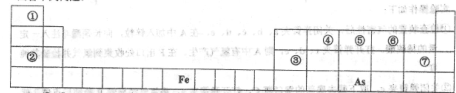
(1)①—⑦号元素原子半径最大的是____,最高价氧化物对应的水化物物酸性最强的是________________.
(2)写出由①-⑦号元素中的几种组成显碱性的盐的化学式____________________。(写出2种即可),并用离子方程式表示其中一种显碱性的原因____________________.
(3)写出③号元素的最高价氧化物与①-⑦号元素中金属性最强的元素的最高价氧化物的水化物反应的离子方程式_____________________。
(4) As在元素周期表中的位置是________________。
⑸As的原子结构示意图为________,其氢化物的电子式为___________.
(6)Y是由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可以与Y的水溶液反应,生成其最高价含氧酸(H3AsO4 ),写出该反应的离子方程式_____________________,
当消耗1mol还原剂时转移电子的物质的量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X的单质既有σ键乂有π键,且X的第一电离能比其相邻元素都大,Y的电负性比X的小,其基态原子最外层的p电子是该层s电子的两倍,Z是前36号元素中原子半径最大的主族元素,W的一种核素的质量数是56,中子数是30。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于 晶体,Z2O2的化学键类型是_______(填编号)
| A.离子键 | B.极性共价键 | C.非极性共价键 | D.金属键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是 ____________族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式),离子是____________(举一例、填电子式)。
(4)A与C形成的化合物中含有的化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题:
(1)元素D在周期表中的位置是 。
(2)画出E的阴离子的结构示意图: 。
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式: 。
写出一种由A、C、D三种元素组成的共价化合物的化学式: 。
(4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中,
完全吸收后,溶液中大量存在的阴离子是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。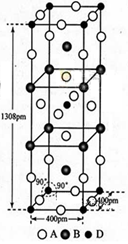
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
( 13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
| A | | | |||||||||||||||
| | | | | M | Q | R | | | |||||||||
| | | E | | | | D | | ||||||||||
| | | | G | | | | J | | | | | | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com