
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( ) 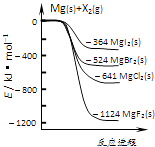
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g),△H=﹣117kJmol﹣1
【答案】D
【解析】解:A、依据图象分析判断,Mg与Cl2的能量高于MgCl2,依据能量守恒判断,所以由MgCl2制取Mg是吸热反应,故A错误;
B、物质的能量越低越稳定,易图象数据分析,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,故B错误;
C、氧化性:F2>Cl2>Br2>I2,故C错误;
D、依据图象Mg(s)+Cl2(l)=MgCl2(s)△H=﹣641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=﹣524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g)△H=﹣117KJmol﹣1,故D正确;
故选D.
A、依据图象分析判断,Mg与Cl2的能量高于MgCl2,据此分析;
B、物质能量越高越活泼,越不稳定;
C、氧化性:F2>Cl2>Br2>I2;
D、根据盖斯定律构建目标方程式书写.


科目:高中化学 来源: 题型:
【题目】下列情况会对人体健康造成较大危害的是( )
A.自来水中通入少量Cl2进行消毒杀菌
B.用食醋清洗热水瓶胆内壁附着的水垢
C.用SO2漂白食品
D.用小苏打发酵面团制作馒头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丁二酸乙二醇酯(PES)是一种生物可降解的聚酯,它在塑料薄膜、食品包装和生物材料方面有着广泛的应用.其结构简式为: 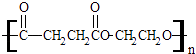 ①聚丁二酸乙二醇酯(PES)是由两种单体通过反应(填反应类型)制得的.形成该聚合物的两种单体是 .
①聚丁二酸乙二醇酯(PES)是由两种单体通过反应(填反应类型)制得的.形成该聚合物的两种单体是 .
②这两种单体相互之间也可能形成一种八元环状酯,请写出该环状化合物的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( ) 
A.CO、CO2均属于酸性氧化物
B.形成化学键时需吸收能量
C.钌催化剂可以改变该反应的焓变
D.CO与O形成化学键过程中有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内水和无机盐的叙述错误的是
A. 越冬或休眠的植物细胞中自由水与结合水的比例升髙,有利于其抵抗不良环境
B. 水既是细胞内良好的溶剂,又是生物体内物质运输的主要介质
C. 无机盐离子对维持血浆渗透压和酸碱平衡等有重要作用
D. 镁是构成叶绿素的必需成分,植物缺乏镁时会导致叶片发黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________(用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
(2)一定量的铜片与100mL 18 mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为_____g,生成的A气体在标准状况下体积为_____L(假设气体全部逸出),剩余的H2SO4的浓度为____________mol/L(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在V L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体m g,关于原溶液说法正确的是 ( )
A. Al3+的物质的量浓度为![]() B. 溶质的物质的量浓度
B. 溶质的物质的量浓度![]()
C. Al3+的物质的量![]() D. SO42-的物质的量浓度
D. SO42-的物质的量浓度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)![]() xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
A. ①③ B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com