
| A. | 用NaOH溶液除去铝箔表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入过量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多 OH-+H+═H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体Al3++3H2O?Al(OH)3 (胶体)+3H+ |
分析 A.氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
C.氢氧化铝为难溶物,离子方程式中氯化铝不能拆开;
D.铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有较大表面积,能够净水.
解答 解:A.用NaOH溶液除去铝箔表面的氧化膜,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故A正确;
B.向AlCl3溶液中加入过量氨水,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B正确;
C.用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多 Al(OH)3+3H+═Al3++3H2O,故C错误;
D.向污水中投放明矾,生成能凝聚悬浮物的胶体,反应的离子方程式为:Al3++3H2O?Al(OH)3 (胶体)+3H+,故D正确;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
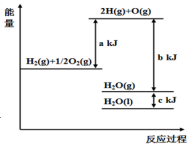
| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
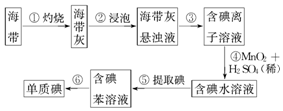
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. .
.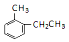 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 的一种同分异构体的结构简式
的一种同分异构体的结构简式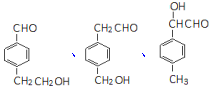 任一种.
任一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
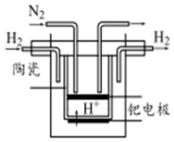 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由MgCl2溶液和NaOH溶液制备Mg(OH)2:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Mg(OH)2悬浊液中滴加浓FeCl3溶液,生成红褐色沉淀:3Mg(OH)2 (s)+2Fe3+═2Fe(OH)3(s)+3Mg2+ | |
| C. | 向Mg(OH)2悬浊液中滴加浓NH4Cl溶液,浊液变澄清:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| D. | 向Mg(OH)2悬浊液中滴加醋酸,浊液变澄清:Mg(OH)2+2H+═Mg2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
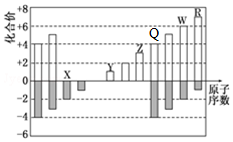 部分短周期元素化合价与原子序数的关系可用图表示.
部分短周期元素化合价与原子序数的关系可用图表示.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com