
下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是( )。

科目:高中化学 来源: 题型:
下列变化中,不属于化学变化的是( )
A.SO2使品红溶液褪色 B.氯气使湿润的红色布条褪色
C.活性碳使红墨水褪色 D.“84”消毒液使某些染料褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
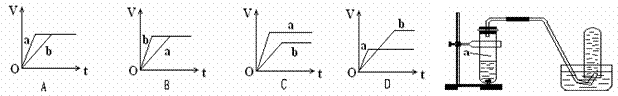

查看答案和解析>>
科目:高中化学 来源: 题型:
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变为浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| ④镁带与2mol/L盐酸反应 | (D)剧烈反应,产生可燃气体 |
| ⑤铝条与2mol/L盐酸反应 | (E)生成白色胶状沉淀,后来沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(1) 实验目的: 研究同周期元素性质递变规律
(2) 实验用品:
仪器: ①________②________③________④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3) 实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4) 实验结论:
金属性: ________________ 非金属性: ________________
(5)写出⑥的总反应离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
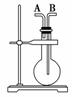 今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用 如 图装置进行实验,填写下列空白:
今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用 如 图装置进行实验,填写下列空白:
(1)当烧瓶干燥时,从A口进气可收集的气体是 ________________,从B口进气可收集的气体是________。
(2)当烧瓶中充满水时,可用来测量________等气体的体积。
(3)当烧瓶中装入某种溶液,用于洗气时,气体应从____ ____口进入烧瓶。
____口进入烧瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向Na[Al(OH)4]溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸 ( )。
A.①② B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。
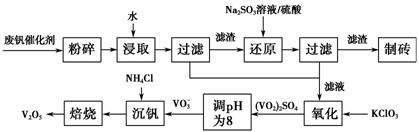
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式__________________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫的氧化速率,此过程中产生了一连串的中间体(如图1)。其中a、c两步的化学方程式可表示为________________________,________________________________。
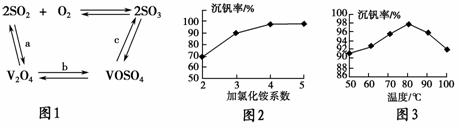
(3)该工艺中沉钒率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵的系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据图2和图3,试建议控制氯化铵系数和温度的适宜值分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量的CO2与SO3,其质量之比为 ,原子数目之比为 。
(2)某气态氧化物化学式为RO2,在标准状下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 ,R的相对原子质量为____________。
(3)10%的硫酸溶液,密度为1.07g/cm3,其物质的量浓度为 。
(保留三位有效数字)
(4)200 mL、2.0 mol/L的Al2(SO4)3溶液中含Al3+的物质的量为 。从中取出10mL,Al2(SO4)3物质的量浓度为 ,若将这10mL溶液用水稀释到50mL,所得溶液中溶质的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com