
铁、铝遇冷的浓硫酸或浓硝酸发生钝化,是物理变化还是化学变化?
科目:高中化学 来源: 题型:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
 (1)该实验应选用 作指示剂;
(1)该实验应选用 作指示剂;
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL;
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C(CH3COOH)= mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
含苯酚的工业废水处理的流程图如图所示:
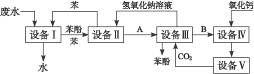
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步操作可以用__________________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_________。由设备Ⅲ进入设备Ⅳ的物质B是_________。
(3)在设备Ⅲ中发生反应的化学方程式为:_______________________________________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和_________。通过操作________________(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在钠、钾、铷,三种单质中,铷的熔点最高
B.充电电池的化学反应原理是氧化还原反应,充电是使放电时的氧化还原反应逆向进行,燃料电池的能量利用率可达100%
C.化学键可以使离子相结合,也可以使原子相结合
D.氟利昂-12(CF2Cl2)有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+ H2(g)
CO2(g)+ H2(g)
已知在25℃时:(1)C(石墨)+1/2O2(g)=CO(g) ΔH1=—111kJ/mol
(2)H2(g)+1/2O2(g)=H2O(g) ΔH2=—242kJ/mol
(3)C(石墨)+O2(g)=CO2(g) ΔH3=—394kJ/mol
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热 。
(2)已知上述反应在427℃ 时的平衡常数是9.4。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/L,计算一氧化碳在此反应条件下的转化率 。(保留3位有效数字)。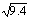 ≈3.07。
≈3.07。
(3)对于化学反应,速率也是研究的重要内容。在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa) ,并在一定温度下使其发生反应:H2(g)+I2(g)  2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
①保持容器容积不变,向其中加入1mol H2。
②保持容器容积不变,向其中加入1mol N2(N2不参加反应)。
③保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应)。
④保持容器内气体压强不变,向其中加入1mol H2和1mol I2。
⑤提高起始的反应温度。
(4)2.0 mol PCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.4 mol B.0.2 mol C.小于0.2 mol D.大于0.2 mol,小于0.4 mol
(5)已知25℃下,醋酸溶液中存在下述关系: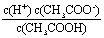 =1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (
=1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (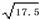 ≈4.18)
≈4.18)
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010 mol/L)
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。
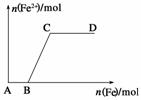
①Fe3+ ②Fe2+ ③Fe、Fe2+
④Fe2+、Fe3+
(1)AB段铁元素以__________形式存 在。
在。
(2)BC段铁元素以__________形式存在。
(3)CD段铁元素以__________形式存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是 ( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
将3.48 g四氧化三铁完全溶解在100 mL 1 mol·L-1的硫酸中,然后加入K2Cr2O7溶液
25 mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O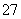 全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是 ( )
全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是 ( )
A.0.05 mol·L-1 B.0.1 mol·L-1
C.0.2 mol·L-1 D.0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是[微软用户7]
A.0.1molN2与足量的H2反应,转移的电子数是0.6NA
B.常温下, 0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1 N A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com