
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
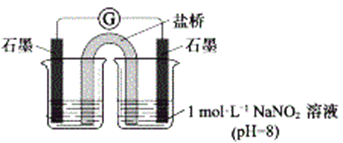
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
【答案】 硫氰化钾 ②两个实验过程均有O2,但NaNO3溶液中无明显变化 1mol/L FeSO4溶液(pH=4) NO2+e+H2O== NO↑+2OH 溶液变为黄色 将NO通入FeSO4溶液中,溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化 棕色溶液中的[Fe(NO)]2+受热生成Fe2+,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀 Fe2++NO2+2CH3COOH=Fe3++NO↑+H2O+2CH3COO 两层液体界面上H+、NO3与Fe2+反应,生成棕色的[Fe(NO)]2+
【解析】(1)①用硫氰化钾溶液检验Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是两个实验过程均有O2,但NaNO3溶液中无明显变化。
③根据原电池原理,为了证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂应为1mol/L FeSO4溶液(pH=4),右侧电极为正极,发生还原反应,NO2被还原成NO,产生无色气体,电极反应式为NO2+e+H2O== NO↑+2OH,左侧烧杯中Fe2+被氧化为Fe3+,因此现象为:溶液变为黄色。
(2)①实验Ⅲ的目的是:证实溶液呈棕色只是因为Fe2+与NO发生了反应,因此实验Ⅲ为对照试验,操作和现象是:将NO通入FeSO4溶液中,溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。原因是棕色溶液中的[Fe(NO)]2+受热生成Fe2+,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀。
(3)从表格知,三个实验为对照实验,①ⅰ中溶液变为棕色是NO2在醋酸溶液中将Fe2+氧化为Fe3+,同时生成NO,Fe2++NO =[Fe(NO)]2+,所以离子方程式是Fe2++NO2+2CH3COOH=Fe3++NO↑+H2O+2CH3COO 、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色原因是两层液体界面上H+、NO3与Fe2+反应,生成棕色的[Fe(NO)]2+
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列四种粒子中,半径按由大到小的排列顺序是( )
①基态X的原子结构示意图: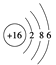 ②基态Y的价电子排布式:3s23p5
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式: ![]()
A. ③>①>②>④ B. ③>②>①>④ C. ①>③>④>② D. ①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇钡铜氧(YBa2Cu3O7-x)类高温超导材料(其中Y显+3价,Cu显+2、+3价)可由Y2(CO3)3、BaCO3和CuCO3混合在高温下反应制得。回答下列问题:
(1)Y(钇)是一种稀土金属元素,与Sc(钪)同族相邻。X在元素周期表中的位置是_______,目前的周期表中,该族共有______种元素。
(2)基态Cu3+的电子排布式为________。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是____________________________________。
(3) CO32-中C原子釆取_______杂化;第一电离能:C_____O(填“>”或“<”)。
(4)某种钇钡铜氧材料中x=0.2,则n(Cu3+):n(Cu2+)=________。
(5)如图是另一种钇钡铜氧超导材料的晶胞结构示意图,其化学式为______,晶体中Y3+的坐标是______;若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则该晶体的密度为____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C8H10, Z的空间结构类似于篮子。下列说法正确的是

A. 化合物W的同分异构体只有X、Y、Z
B. W、X、Y、Z中能使酸性KMnO4溶液褪色的有2种
C. W、Z的一氯代物中数目较少的Z
D. 1molX、1molY 与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是

A. Pt上发生氧化反应
B. Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2
C. 反应过程中转移OH-的物质的量为0.25bmol
D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_________________________________。
(2)在NH3·BF3中,________原子提供孤对电子,________原子接受电子。
(3)写出NH3·BF3的电子式并用“→”标出配位键。______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对原子结构的探究经历了多个历史阶段.下列各阶段的先后顺序正确的是( )
①徳谟克利特提出的古典原子论 ②道尔顿提出的近代原子论
③卢瑟福提出原子结构的“行星模型”④汤姆逊提出原子结构的“葡萄干面包模型”
A.①②③④
B.①②④③
C.①③④②
D.④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 空气、硫酸铜、硫酸B. 醋酸、液氯、纯碱
C. 硝酸、食盐水、烧碱D. 氧化铁、胆矾、熟石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com