

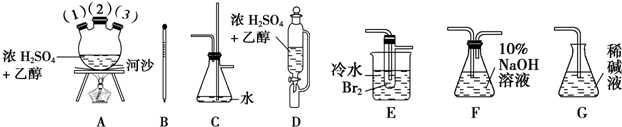
分析 (1)给试管中的固体加热时,试管口应该稍稍向下倾斜;根据图示装置及实验目的可知:B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中氧化铜与一氧化碳反应制取铜;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,最后收集CO气体;
(2)纯度不足时一氧化碳气体会发生爆炸,所以先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时,应该先熄灭D处酒精灯,然后再熄灭A处酒精灯;
(3)①根据配制一定物质的量浓度的溶液的方法判断需要的仪器;
②根据反应原理及高锰酸钾的物质的量计算出该草酸晶体中含有草酸的物质的量、质量,再计算出结晶水的物质的量,最后计算出x;
解答 解:(1)反应中有水生成,容易导致试管炸裂,所以A装置中试管口应向下倾斜;B为澄清石灰水,目的是除去混合气体中二氧化碳,C为浓硫酸,目的是干燥CO气体;D中CuO与CO反应制取Cu;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,
故答案为:试管口应向下倾斜;浓硫酸;安全瓶(或防倒吸);
(2)CO气体的纯度不足时会发生爆炸现象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度,
故答案为:①③④②;验纯;
(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②16mL 0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该醋酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×$\frac{100ml}{20ml}$=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.17g样品中含有草酸的物质的量为:0.004mol×$\frac{5}{2}$=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:$\frac{1.26g-0.9g}{18g/mol}$=0.02mol,则该草酸晶体中x=$\frac{0.02mol}{0.01mol}$=2,
故答案为:2;
点评 本题考查了探究物质组成、称量物质含量的方法,题目难度中等,熟练掌握化学实验基本操作方法为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力,是一道质量较好的题目.


科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应是炼铁最常用的方法 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 | |
| D. | 袋装食品常用生石灰包作为食品的抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水乳交融,火上浇油”前者包含物理变化,后者包含化学变化 | |
| B. | “滴水石穿.绳锯木断”不包含化学变化 | |
| C. | “蜡炬成灰泪始干”包含的是物理变化 | |
| D. | 石灰吟中“烈火焚烧若等闲”指的是加热,不包含化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
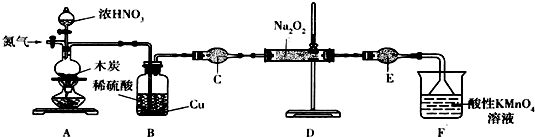
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
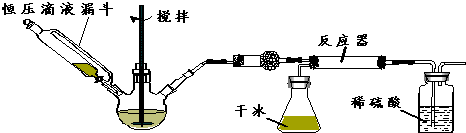
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
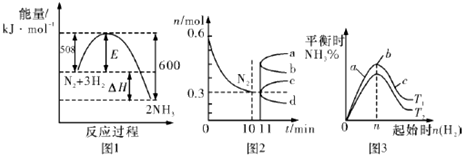
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com