
 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4分析 (1)根据MnO2+SO2=MnSO4可知,n(SO2)=n(MnO2);
(2)pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析;
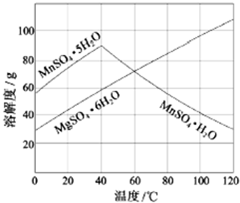
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,根据图上信息,高于60℃以后MnSO4•H2O的溶解度减小,而MgSO4•6H2O的溶解度增大,因此控制结晶温度范围是高于60℃;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=0.02L×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4•H2O)=1.00×10-3mol×169g/mol=0.169g,以此计算纯度.
解答 解:(1)根据MnO2+SO2=MnSO4可知,n(SO2)=n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,其体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(2)pH=7.1时Mn(,除去OH)2开始沉淀.室温下MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol•L-1,解得:c(OH-)=1×10-9mol•L-1,c(H+)=1×10-5mol•L-1pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,故pH范围是:5.0<pH<7.1,故答案为:5.0<pH<7.1;
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,根据图上信息,高于60℃以后MnSO4•H2O的溶解度减小,而MgSO4•6H2O的溶解度增大,因此控制结晶温度范围是高于60℃这样可以得到纯净的MnSO4•H2O,故答案为:高于60℃;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=0.02L×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4•H2O)=1.00×10-3mol×169g/mol=0.169g,纯度为$\frac{0.169g}{0.1710g}$×100%=98.8%,
答:MnSO4•H2O样品的纯度为98.8%.
点评 本题考查较综合,涉及氧化还原反应计算、溶度积计算及混合物分离、图象分析等,本题为2015年江苏高考题18题,综合性较强,侧重分析、计算能力的综合考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有HNO3和H2SO4,将其倒入NaOH溶液中,静止,分液 | |
| D. | 乙烯中混有SO2,将其通入酸性高锰酸钾溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2所含的阴离子 | |
| B. | 1L0.1mol•L-1氨水中的NH4+ | |
| C. | 12.5mL16mol•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6gNO2气体所含的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可以使溴水褪色,发生加成反应 | |
| B. | 甲烷和氯气在光照条件下反应,反应类型为取代反应 | |
| C. | 乙醇在铜作催化剂并加热条件下生成乙醛,发生还原反应 | |
| D. | 生活中可以用食醋出去水壶中的水垢,主要是利用食醋中醋酸的酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com