
| A、3种 | B、4种 | C、5种 | D、6种 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
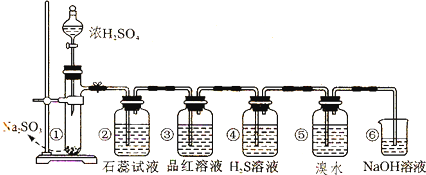
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中各离子浓度为:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | ||||||
| D、③和④等体积混合后溶液的pH<7,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和乙酸都能与金属钠反应,也都能发生酯化反应 |
| B、乙烯和苯都能使酸性KMnO4褪色,也都能发生加成反应 |
| C、乙酸和油脂都能与氢氧化钠溶液反应,也都能发生氧化反应 |
| D、淀粉和蛋白质都是天然高分子化合物,也都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸 |
| B、改变温度能改变任何可逆反应的平衡状态 |
| C、离子反应的结果是自由移动的离子浓度减小 |
| D、Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
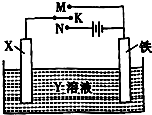 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B、BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeCl2 |
| C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D、BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL 2mol?L-1 葡萄糖溶液中所含分子数为NA |
| B、0.1mol?L-1Na2CO3溶液中的阴离子总数大于0.1NA |
| C、电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2 NA个电子 |
| D、标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com