
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算离子的物质的量,由离子的物质的量和离子的质子数求出电荷数;根据离子个数与质子数、中子数之比求出质子数、质量数;
(2)铝与稀硫酸反应生成硫酸铝和氢气,由此书写出相应的反应方程式.
解答 解:(1)根据n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,而这些阳离子共有6.02×1.3×1023个质子、所以质子数为13,离子所带电荷数为3,而0.1mol离子中含中子数为:6.02×1.4×1023个,所以中子数为14,则A=13+14=27,故答案为:13;3;27;
(2)通过(1)知,该元素是Al,铝与稀硫酸反应生成硫酸铝和氢气,所以反应方程式为2Al+3H2SO4═Al2(SO4)3+3H2↑.答:金属铝与稀H2SO4反应的化学方程式2Al+3H2SO4═Al2(SO4)3+3H2↑.
点评 本题考查了有关阿伏伽德罗常数的计算和化学反应方程式的书写,难度不大,明确物质的量之比等于微粒个数之比是解本题的关键.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.
(I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.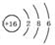 ,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为
,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为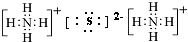 或
或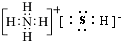 .
.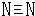
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.0075 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•mim-1 | ||
| C. | v(C)=0.5 mol•L-1•s-1 | D. | v(D)=0.4 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com