
分析 (1)钠与水反应生成氢氧化钠和氢气,2Na$\stackrel{-2e-}{→}$2 Na+,2H2O$\stackrel{+2e-}{→}$2OH-+H2↑;
(2)根据n(NaOH)=n(HCl),结合c=$\frac{n}{V}$计算求解;
(3)Na和水反应生成H2,由n(H2)=$\frac{V}{{V}_{m}}$计算n(Na),$\frac{1}{2}$n(Na2O)+n(Na)=n(NaOH)=0.03mol,带入m=nM计算Na、Na2O的质量,最后带入ω=$\frac{m(N{a}_{2}O)}{m(Na)+m(N{a}_{2}O)}$×100%计算.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,2Na$\stackrel{-2e-}{→}$2 Na+,2H2O$\stackrel{+2e-}{→}$2OH-+H2↑, ,
,
答:钠与水发生反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,转移电子情况为 ;
;
(2)根据n(NaOH)=n(HCl)=1mol•L-1×30×10-3L=0.03mol,所得NaOH溶液中溶质的物质的量浓度c=$\frac{n}{V}$=$\frac{0.03mol}{0.1L}$=0.3mol/L,
答:NaOH溶液中溶质的物质的量浓度为0.3mol/L;
(3)n(H2)=$\frac{V}{{V}_{m}}$=$\frac{0.224L}{22.4L/mol}$=0.01mol,由2Na+2H2O═2Na++2OH-+H2↑,可知n(Na)=2n(H2)=0.02mol,m(Na)=0.02mol×32g/mol=0.46g,
由$\frac{1}{2}$n(Na2O)+n(Na)=n(NaOH)=0.03mol可知,n(Na2O)=$\frac{1}{2}×$(0.03mol-0.02mol)=0.005mol,m(Na2O)=0.005mol×62g/mol=0.31g,
因此钠块中氧化钠的质量分数ω=$\frac{m(N{a}_{2}O)}{m(Na)+m(N{a}_{2}O)}$×100%=$\frac{0.31g}{0.46g+0.31g}$×100%=40%,
答:钠块中氧化钠的质量分数为40%.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,注意原子守恒的灵活运用,注意溶液质量分数的计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b | |
| D. | 已知P(红磷,s)═p(白磷,s)△H>0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol磷酸钾中阴离子所带电荷数为NA | |
| B. | 在18g18O2中含有NA个18O原子 | |
| C. | 0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA | |
| D. | 将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(NH4+)>c(Cl-)>c(OH-)>c( H+) | B. | c(Cl-)>c(NH4+)>c( H+)>c(OH-) | ||
| C. | c(NH4+)+c( NH3)=c(Cl-)+c(OH-) | D. | c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
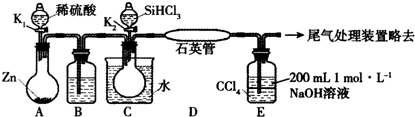
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
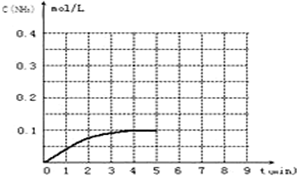
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com