
1000mLij����Һ�г�����0.2mol.L-1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl-��Br-��CO32-��HCO3-��SO32-��SO42- |
�ֽ�������ʵ�������ÿ��ʵ�������Լ�����������

��1��д�����ɰ�ɫ����B�����ӷ���ʽ: ��
��2������Һ�п϶������ڵ��������� ��
��3������ɫ����D�ǵ�һ���壺
������ | Cl- | Br- | CO32- | HCO3- | SO32- | SO42-11777437 |
Ũ��/mol.L �� |
�ٽ������ӵ����ʵ���Ũ�������ϱ��У�һ�������ڵ��0��������ȷ���������)��
���ж�ԭ��Һ��K+�Ƿ���ڣ������ڣ��������ʵ���Ũ�ȵ���Сֵ���������ڣ���˵������: ��
��4������ɫ����D�ǻ�����壺
�ٴ���Һ��һ�����е��������� ��
�ڳ���A������ϡ���ᷴӦ�ijɷ��� (д��ѧʽ����
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
����ѡ�����ܱ�ʾ�����ӵ�������ֵ����
A��1mol H+ ���еĵ����� B����״����,22.4L�ƾ������ķ�����
C��1.6 g CH4 ���е������� D��1L 1mol/L����������Һ������Na+ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
��ѧ������ϢϢ��ء�����������ȷ����( )
A����ե��֭������ˮ����� B����ͷԽ��Խ��
C����֬��ˮ��ɱ�������� D�������еĵ��۾�ˮ��ɱ�ɾ�(�Ҵ�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶��������Ļ�ѧ���������棩 ���ͣ�ѡ����
�ڱ��ݡ��칫¥�ȹ�����������ʹ��һ�ֵ���ʽ��������������������һ�������ѩ�241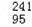 ��Am������Դ�ĵ����ҡ�
��Am������Դ�ĵ����ҡ� Amԭ�Ӻ�������������������֮���ǣ� ��
Amԭ�Ӻ�������������������֮���ǣ� ��
A. 241 B. 146 C. 95 D. 51
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶��������Ļ�ѧ���������棩 ���ͣ�ѡ����
���DZ����ʳ��������ά���������������Ҫ�ĸ���Ԫ�أ����ij��Ԫ�����벻�����࣬�ͻ�Ӱ�����彡���������¼����������й�˵��������ǣ� ��
A������ȱ��������״���״�
C��ȱ�������ȱ����ƶѪ
B����ͯȱ��ᵼ�·����ٻ�
D��ȱп��Ӱ����������ݵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����ϰ��ڿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ƶ�ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A���Ʊ�Al(OH)3����Һ����lmol.L-1��AlCl3��Һ�мӹ�����6mol.L-1NaOH��Һ
B���ᴿ���������������������������������������������м�������������Һ�����÷�Һ������ȥ�л����ˮ
C��������Һ���Ƿ���Fe3+:ȡ������������Һ�������м�������������ˮ���ٵμ�KSCN��Һ���۲�ʵ������
D��̽��������H2O2�ֽ����ʵ�Ӱ�죺����ͬ�����£���һ֧�Թ��м���2mL5%H2O2��1mLH2O������һ֧�Թ��м���2mL5%H2O2��1mLFeCl3��Һ���۲첢�Ƚ�ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����ϵڶ��ο���ѧ�Ծ��������棩 ���ͣ��ƶ���
��ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�����
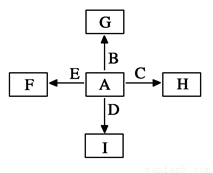
��֪����GΪ����ɫ���壬�ܷ�����ӦC��G B��H���÷�Ӧ��ų�
B��H���÷�Ӧ��ų�
�������Ȣ�I��һ�ֳ������������壬����E���Է�����Ӧ��
2E��I 2F��D��F��EԪ�ص���������Ϊ60%���ش����⣺
2F��D��F��EԪ�ص���������Ϊ60%���ش����⣺
(1)���з�Ӧ�Ļ�ѧ����ʽΪ_____________________��
(2)������I�ĵ���ʽΪ___________�����Ŀռ乹����________________��
(3)8.0g G�������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ��������������ͭ�۵�����____________g��
(4)C�����NaOH��Һ��Ӧ����Һ�����������I��Ӧ�����ӷ���ʽΪ_____________��
(5)E��I��ȼ�չ۲쵽��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ������ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ʵ����
MnO2��һ����Ҫ�������ܲ��ϣ���ҵ�ϴ��̽������ȡ������MnO2������������ͼ��ʾ��
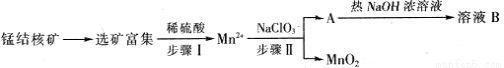
�������ܵĵ�����ܶȻ�����(Ksp)���±���
������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10��17 | 10��17 | 10��39 |
��֪��һ�������£�MnO4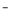 ����Mn2+��Ӧ����MnO2
����Mn2+��Ӧ����MnO2
��1�������������0. 5molMn2+ʱ����ȥ1mol•L-1��NaClO3��Һ200ml���÷�Ӧ���ӷ���ʽΪ
��2����֪��ҺB������֮һ�� ѭ���������������������ʵ�������_____________��
ѭ���������������������ʵ�������_____________��
��3��MnO2�Ǽ���п�̵�ص��������ϣ��ŵ���̲���MnOOH���õ�������ĵ缫��Ӧʽ�� �����ά�ֵ���ǿ��Ϊ5A����ع�������ӣ���������п g������֪F=96500C/mol��
��4����Ͼ�п�̵���ڵĻ�����Ҫ�ɷ�MnOOH��Zn(OH)2 ���м���һ������ϡ�����ϡ���ᣨH2C2O4���������Ͻ�������CO2����Ϊֹ��д��MnOOH���뷴Ӧ�����ӷ���ʽ ��
���м���һ������ϡ�����ϡ���ᣨH2C2O4���������Ͻ�������CO2����Ϊֹ��д��MnOOH���뷴Ӧ�����ӷ���ʽ ��
����������Һ�еμӸ��������Һ������ɫ���������ʵ��֤����ɫ�����ɷ�ΪMnO2 ��
��5���÷ϵ�ص�пƤ����ZnSO4•7H2O�Ĺ����У����ȥпƤ�е��������������䷽���ǣ�����ϡH2SO4��H2O2�����ܽ��ΪFe3+���Ӽ����pHΪ ʱ�����պó�����ȫ������Ũ��С��1��10��5mol•L��1ʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪ ʱ��п��ʼ�������ٶ�Zn2+Ũ��Ϊ0.1mol•L��1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹŸ����ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
SO2��CO��CO2��NOx�ǶԻ���Ӱ��ϴ�ļ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����
��1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ��ʾ��
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��һ���缫��Ӧʽ ��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ ��
����AΪNO2��BΪO2��CΪHNO3�����ĵ缫��ӦʽΪ ��
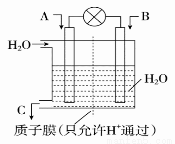
��2��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650 �棬�ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1��1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ��
�ٵ�ظ�����ӦʽΪ ��
���Դ˵�Դ�����������������Һ�����������������Ϊ21.6 g������������������������Ϊ L��������Һ���Ϊ2 L����Һ��pHԼΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com