
Fe(OH)3+ClO-+OH-——![]() +Cl-+H2O
+Cl-+H2O
(2)已知有1.07 g Fe(OH)3参加反应时,共转移了1.81×1022个电子,则n=__________,![]() 中铁的化合价为_________。
中铁的化合价为_________。
(3)根据(1)(2)推测,![]() 能和下列________(只填序号)物质发生反应。
能和下列________(只填序号)物质发生反应。
A.KMnO4 B.SO2 C.H2S D.O2
(1)2Fe(OH)3+(5-n)ClO-+2nOH-====2![]() +(5-n)Cl-+(n+3)H2O
+(5-n)Cl-+(n+3)H2O
(2)2 +6价
(3)BC
解析:(1)由化合价升降法配平,设![]() 中Fe元素的化合价为x,x=+(8-n),则
中Fe元素的化合价为x,x=+(8-n),则![]() 化合价升高为:(8-n)-3=(5-n),而Cl元素化合价降低为2;最小公倍数为:2(5-n)。由此得出配平的结果为:
化合价升高为:(8-n)-3=(5-n),而Cl元素化合价降低为2;最小公倍数为:2(5-n)。由此得出配平的结果为:
2Fe(OH)3+(5-n)ClO-+2nOH-====2![]() +(5-n)Cl-+(n+3)H2O
+(5-n)Cl-+(n+3)H2O
(2)参加反应的n〔Fe(OH)3〕=![]() =0.010 mol,1 mol Fe(OH)3转移电子的物质的量为
=0.010 mol,1 mol Fe(OH)3转移电子的物质的量为 ,即铁元素的化合价由+3升高到+6,+6=+(8-n)
,即铁元素的化合价由+3升高到+6,+6=+(8-n)![]() n=2。
n=2。
(3)一般情况下,同种元素的化合价越高,氧化性越强,故可推知![]() 的氧化能力比Fe3+的强,所以得出
的氧化能力比Fe3+的强,所以得出![]() 能氧化SO2和H2S,选BC。
能氧化SO2和H2S,选BC。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | - 4 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
| O | 2- 8 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | n- 4 |
| O | n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +______,
+______,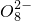 +H2O→Mn
+H2O→Mn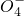 +S
+S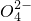 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com