
【题目】在工业上,合成氨与制备硝酸一般可连续生产,流程如下:
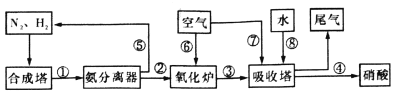
(1)合成塔中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___________300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___________300℃(填“>”、“<”或“=”)。
![]()
(2)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气—氧气燃料电池,电解质溶液为KOH,则负极电极发生反应的电极反应式为___________________。
(3)在80℃时,将铜与浓硝酸反应得到的0.40mol N2O4气体充入2L已经抽空的固定的密闭容器中发生反应N2O4 (g)![]() 2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:

①计算a=_________,此温度时该反应的平衡常数K=____________;
②改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有___________(填序号)。
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体
(4)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮的氧化物还原为氮气和水,反应机理为:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJmol﹣1
4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJmol﹣1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJmol﹣1
2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJmol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为:____________________ .
【答案】(1)<;
(2)2NH3-6e-+6OH-= N2+6H2O;
(3)①0.28,1.8;②A;
(4)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJmol-1。
【解析】
试题分析:(1)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<300℃,故答案为:<;
(2)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+5O2![]() 4N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为: 2NH3-6e-+6OH-=N2+6H2O;
4N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为: 2NH3-6e-+6OH-=N2+6H2O;
(3)①生成0.24mol二氧化氮需要0.12mol四氧化二氮分解,a=0.40mol-0.12mol=0.28mol;
结合化学平衡三段式列式计算
N2O4(g)![]() 2NO2(g)
2NO2(g)
起始量(mol) 0.4 0
变化量(mol) 0.3 0.6
平衡量(mol) 0.1 0.6
K= =1.8mol/L,故答案为:0.28mol;1.8mol/L;
=1.8mol/L,故答案为:0.28mol;1.8mol/L;
②若使c(NO2)/c(N2O4)值变小,需使平衡向逆反应方向移动。A、增大N2O4的起始浓度,按勒夏特列原理,平衡移动的结果只能减弱这种改变,不能消除,所以,c(NO2)/c(N2O4)值变小,故A正确;B、升高温度会使平衡向生成二氧化氮的方向移动,会使c(NO2)/c(N2O4)值变大,故B错误;C、催化剂只能加快化学反应速率,不会影响平衡移动,故C错误;D、向混合气体中通入稀有气体,反应物和生成物浓度不变,不影响平衡移动,c(NO2)/c(N2O4)值不变,故D错误;故答案为:A;
(4)将两个方程式相加然后除以2即得甲烷直接将NO2还原为N2的热化学方程式,反应方程式为CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJmol-1,故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJmol-1。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关检测生物组织中糖类、脂肪和蛋白质实验的叙述,正确的是
A. 斐林试剂的甲液与双缩脲试剂的A液的化学成分是相同的
B. 还原糖和蛋白质的鉴定过程都需要水浴加热
C. 检测生物组织中的还原糖时可采用西瓜汁作材料
D. 检测花生子叶中的脂肪实验时,可用稀盐酸洗去浮色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
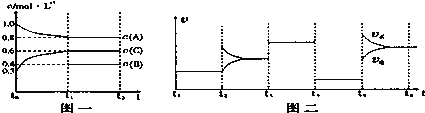
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=___________.
(2)t4-t5阶段改变的条件为____________,B的起始物质的量为____________。各阶段平衡时对应的平衡常数如下表所示:
t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
K1 | K2 | K3 | K4 | K5 |
K1、K2、K3、K4、K5之间的关系为____________(用“>”、“<”或“=”连接)。
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 吃蔬菜能补充的营养素主要是蛋白质
B. 最外层电子数小于4的微粒,一定容易失去电子
C. 质子数相同的微粒,不一定是同种元素
D. 尿素CO(NH2)2属于复合肥料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH) C.c(H+)/ KW D.c(H+)/c(OH-)
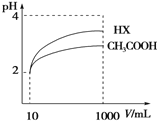
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的 c(H+)______________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或 “小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
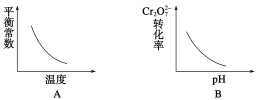
【题目】电镀废液中Cr2O![]() 可通过下列反应转化成铬黄(PbCrO4):Cr2O
可通过下列反应转化成铬黄(PbCrO4):Cr2O![]() (aq)+2Pb2+(aq)+H2O(l)
(aq)+2Pb2+(aq)+H2O(l) ![]() 2PbCrO4(s)+2H+(aq) ΔH<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
2PbCrO4(s)+2H+(aq) ΔH<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
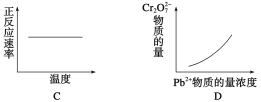
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在电离平衡H2O(l)![]() H+(aq)+OH-(aq) △H>0,下列叙述一定正确的是
H+(aq)+OH-(aq) △H>0,下列叙述一定正确的是
A.向水中加入KHSO4溶液,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低
D.向水中加入AlCl3溶液,平衡向右移动,Kw增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com