
| A. | 2 L二氧化碳分解生成2 L一氧化碳和1 L氧气吸收576 kJ热量 | |
| B. | 恒压条件下生成物的总焓大于反应物的总焓 | |
| C. | 在相同条件下,2 mol一氧化碳与1 mol氧气的能量总和大于2 mol二氧化碳的能量 | |
| D. | 一氧化碳的燃烧热是566 kJ/mol |
分析 热化学方程式中化学计量数表示物质的量,且物质的量与热量成正比,反应遵循能量守恒定律,燃烧热为1molCO燃烧放出的热量,以此来解答.
解答 解:A.化学计量数不能表示体积关系,且状况未知,不能确定体积与热量的关系,故A错误;
B.反应遵循能量守恒,该反应为放热反应,放热反应中生成物的总焓小于反应物的总焓,故B错误;
C.该反应为放热反应,放热反应中反应物的总能量大于生成物的总能量,则在相同条件下,2 mol一氧化碳与1 mol氧气的能量总和大于2 mol二氧化碳的能量,故C正确;
D.由2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol可知,1molCO燃烧放出热量为283kJ,则一氧化碳的燃烧热是283 kJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学方程式中的化学计量数、燃烧热为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
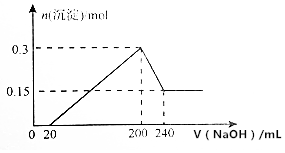 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示(不考虑金属和盐酸反应时HCl的挥发).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
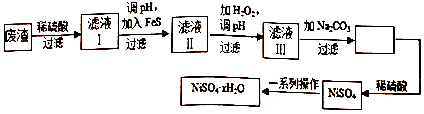
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
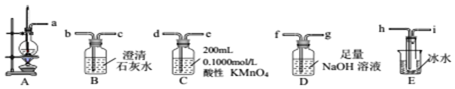
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:X<T<Z | ||
| C. | 气态氢化物的还原性:X<T<R | D. | 最高价氧化物的水化物酸性:Q<T<R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 检验操作 | 现象 | 结论 | |
| A | 加入盐酸酸化的氯化钡 | 产生白色沉淀 | 一定有 SO42- |
| B | 加入氯水与四氯化碳 | 有机层呈紫色 | 一定有 I- |
| C | 加入足量稀盐酸 | 产生无色气体 | 一定有 CO32- |
| D | 加入硝酸银 | 产生白色沉淀 | 一定有 Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
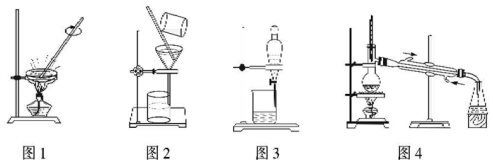
| A. | 用图1所示装置蒸发FeCl3溶液制得无水FeCl3 | |
| B. | 用图2所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 | |
| C. | 用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 | |
| D. | 用图4所示装置从CH3COOH与CH3COOC2H5的混合物中分离出乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com