
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
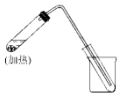 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在阴极附近的溶液中滴入紫色石蕊试液,溶液呈红色 | |
| B. | 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 | |
| C. | 电解时在阳极得到氯气,在阴极得到金属钠 | |
| D. | 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液变回NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
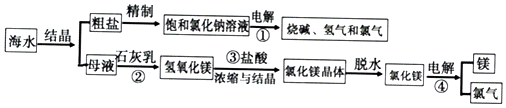
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
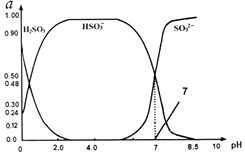 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:选择题
下列实验操作及现象与实验结论一致的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
D | 向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com