
A~G是几种烃分子的球棍模型,据此回答下列问题:

(1)常温下含碳量最高的烃是 (填对应字母)。
(2)能够发生加成反应的烃有 (填数字)种。
(3)一卤代物种类最多的是 (填对应字母)。
(4)等质量的上述七种烃,完全燃烧时消耗O2最多的是 (填对应字母,下同)。等物质的量的上述七种烃,完全燃烧时消耗O2最多的是 。
(5)在120℃,1.01×105Pa下与足量O2混合点燃,完全燃烧后气体体积没有变化的烃是 (填对应字母)。
由球棍模型可知,A为甲烷(CH4),B为乙烷(CH3CH3),C为乙烯(CH2 CH2),D为丙烯(CH2
CH2),D为丙烯(CH2 CHCH3),E为丙烷(CH3CH2CH3),F为苯(C6H6),G为甲苯(C7H8)。(1)含碳量最高的烃是苯。(2)能够发生加成反应的烃是乙烯、丙烯、苯、甲苯。(3)一卤代物种类分别是1、1、1、3、2、1、4。(4)烃的燃烧通式为CxHy+(x+
CHCH3),E为丙烷(CH3CH2CH3),F为苯(C6H6),G为甲苯(C7H8)。(1)含碳量最高的烃是苯。(2)能够发生加成反应的烃是乙烯、丙烯、苯、甲苯。(3)一卤代物种类分别是1、1、1、3、2、1、4。(4)烃的燃烧通式为CxHy+(x+ )O2
)O2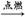 xCO2+
xCO2+ H2O,由此可知等物质的量烃燃烧,耗氧量与(x+
H2O,由此可知等物质的量烃燃烧,耗氧量与(x+ )成正比,故等物质的量上述七种烃完全燃烧G耗氧量最多;等质量的烃燃烧耗氧量与
)成正比,故等物质的量上述七种烃完全燃烧G耗氧量最多;等质量的烃燃烧耗氧量与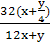 有关,整理上式可得
有关,整理上式可得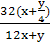 =8×(1-
=8×(1-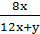 )=8×(1-
)=8×(1-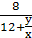 ),所以等质量的烃燃烧,耗氧量与
),所以等质量的烃燃烧,耗氧量与 成正比,故等质量的上述七种烃完全燃烧,耗氧量最多的是A。(5)根据烃燃烧的通式CxHy+(x+
成正比,故等质量的上述七种烃完全燃烧,耗氧量最多的是A。(5)根据烃燃烧的通式CxHy+(x+ )O2
)O2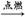 xCO2+
xCO2+ H2O可知,当y=4时,完全燃烧后气体体积没有变化。
H2O可知,当y=4时,完全燃烧后气体体积没有变化。
答案:(1)F (2)4 (3)G (4)A G (5)A、C


科目:高中化学 来源: 题型:
周期表中17号元素的原子37Cl和6号元素的原子13C的原子相比较,前者的下列数据是后者的4倍的是( )
A.中子数 B.最外层电子数
C.电子层数 D.次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应为:Cu+2Fe3+====Cu2++2Fe2+下列能实现该反应的原电池
是 ( )
| A | B | C | D | |
| 电极材料 | Cu、Zn | Cu、C | Fe、Zn | Cu、Ag |
| 电解液 | FeCl3 | Fe(NO3)2 | CuSO4 | Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对达到平衡状态的可逆反应X+Y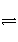
 Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则X、Y、Z、W 4种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则X、Y、Z、W 4种物质的聚集状态为( )
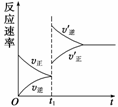
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
如果苯泄漏,以下处理方法错误的是 ( )
A.撤离污染区人员至安全地带,防止苯蒸气对人体造成危害
B.切断电源,因为苯是一种易挥发、易燃物质,否则可能引起爆炸
C.采用活性炭吸附地面液体
D.由于现场比较空旷,采用点火焚烧的办法清除泄漏物
查看答案和解析>>
科目:高中化学 来源: 题型:
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图,回答以下问题:
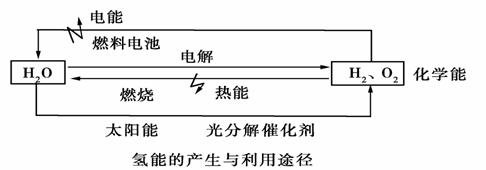
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:①________________________________,②________________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
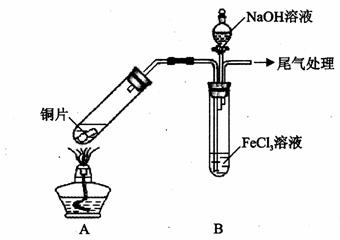
(1)实验前,应先检查装置的 ;实验中产生的尾气应通人 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO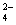 。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:

向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是 。
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ. 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com