
如图所示各步转化关系中,①②③反应是化合反应,④⑤反应是置换反应,则表中各物质之间不能通过一步反应实现如图所示转化关系的是( )
|
| a | b | c |
| A | C | CO2 | CO |
| B | Br2 | FeBr2 | FeBr3 |
| C | Al | AlCl3 | Al2O3 |
| D | Fe | FeCl2 | FeCl3 |
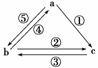
答案 C
解析 A中,符合条件的如①2C+O2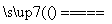 2CO,②CO2+C
2CO,②CO2+C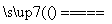 2CO,③2CO+O2
2CO,③2CO+O2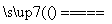 2CO2,④2Mg+CO2
2CO2,④2Mg+CO2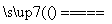 C+2MgO,⑤C+2H2O
C+2MgO,⑤C+2H2O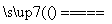 CO2+2H2,成立;B中,符合条件的如①2Fe+3Br2
CO2+2H2,成立;B中,符合条件的如①2Fe+3Br2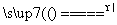 2FeBr3,②2FeBr2+Br2===2FeBr3,③Fe+2FeBr3===3FeBr2,④3Cl2+2FeBr2===2Br2+2FeCl3,⑤Br2+FeI2===I2+FeBr2,成立;选项C中AlCl3不可能通过一步反应转化为Al2O3,且Al2O3不可能通过化合反应生成AlCl3;D中,符合条件的如:①2Fe+3Cl2
2FeBr3,②2FeBr2+Br2===2FeBr3,③Fe+2FeBr3===3FeBr2,④3Cl2+2FeBr2===2Br2+2FeCl3,⑤Br2+FeI2===I2+FeBr2,成立;选项C中AlCl3不可能通过一步反应转化为Al2O3,且Al2O3不可能通过化合反应生成AlCl3;D中,符合条件的如:①2Fe+3Cl2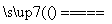 2FeCl3,②2FeCl2+Cl2===2FeCl3,③Fe+2FeCl3===3FeCl2,④Zn+FeCl2===Fe+ZnCl2,⑤Fe+CuCl2===FeCl2+Cu,成立。
2FeCl3,②2FeCl2+Cl2===2FeCl3,③Fe+2FeCl3===3FeCl2,④Zn+FeCl2===Fe+ZnCl2,⑤Fe+CuCl2===FeCl2+Cu,成立。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
在100 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+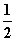 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+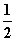 O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的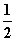 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为285.8 kJ·mol-1
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的 ( )
①固体NaOH ②固体KOH ③固体NaHCO3 ④固体CH3COONa ⑤冰醋酸
A.只有①② B.只有②⑤ C.只有②④⑤ D.只有①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大量存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
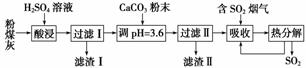
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是
________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是
________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属冶炼与处理常涉及氧化还原反应。
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________ mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)
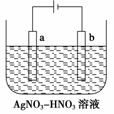
右图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为________。
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,使Ag2S转化为Ag,食盐水的作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
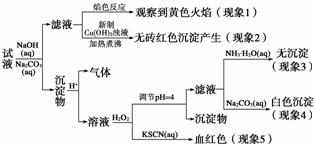
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.该实验中可加入MgO调节pH=4
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值。下列说法正确的是( )
A.1 mol甲苯含有6nA个C—H键
B.18 g H2O含有10nA个质子
C.标准状况下,22.4 L氨水含有nA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成nA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的叙述正确的是
A.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
B.SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物
C.乙烯能使溴水、酸性高锰酸钾溶液褪色,说明乙烯具有漂白性
D.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,因为铁钉表面形成了一层致密稳定的氧化膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com