

| A. | 试样溶液中肯定存在S2O32-、CO32-,可能含有NH4+、Al3+、K+ | |
| B. | 沉淀1的成分肯定为BaSO4和S的混合物 | |
| C. | 将少量气体1通入溶液2中肯定会产生白色沉淀 | |
| D. | 取少量溶液1滴加KSCN溶液,溶液显红色 |
分析 试样中加入过量稀盐酸和氯化钡溶液,生成气体1和沉淀1,且该气体能使澄清石灰水变浑浊,说明含有CO32-或S2O32-或二者都有,也可能含有SO42-;沉淀1可能是S或BaSO4或二者混合物;
溶液1中加入足量NaOH溶液,溶液2没有明显现象,说明原溶液中不含Fe3+、Al3+、Mg2+;
向试样中加入少量硝酸银溶液,无明显现象,说明溶液中一定含有S2O32-;
根据以上现象无法确定是否含有K+、NH4+,据此分析解答.
解答 解:试样中加入过量稀盐酸和氯化钡溶液,生成气体1和沉淀1,且该气体能使澄清石灰水变浑浊,说明含有CO32-或S2O32-或二者都有,也可能含有SO42-;沉淀1可能是S或BaSO4或二者混合物;
溶液1中加入足量NaOH溶液,溶液2没有明显现象,说明原溶液中不含Fe3+、Al3+、Mg2+;
向试样中加入少量硝酸银溶液,无明显现象,说明溶液中一定含有S2O32-;
根据以上现象无法确定是否含有K+、NH4+,
A.试样溶液中肯定存在S2O32-,可能含有CO32-或SO42-或二者都有,可能含有NH4+、K+,一定没有Al3+,故A错误;
B.沉淀1的成分可能为BaSO4、BaCO3、S或它们的混合物,故B错误;
C.气体1为二氧化碳或二氧化硫,二氧化碳或二氧化硫与NaOH反应生成碳酸根离子、亚硫酸根离子,碳酸根离子、亚硫酸根离子和钡离子反应生成沉淀,故C正确;
D.溶液1中不含铁离子,所以取少量溶液1滴加KSCN溶液,溶液不显红色,故D错误;
故选C.
点评 本题考查物质检验实验方案设计,为高频考点,明确物质性质及物质之间反应是解本题关键,注意:亚硫酸根离子能和稀盐酸反应生成气体和沉淀,为易错点.


科目:高中化学 来源: 题型:解答题
 .该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.
.该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
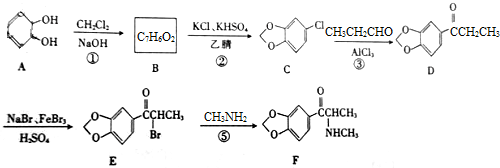

 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 40 | B. | 65 | C. | 90 | D. | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)═6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.| 时间/min 物质的量/mol 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| CO(g) | 0.100 | 0.070 | 0.050 | 0.044 | 0.040 | 0.040 |
| SO2(g) | 0.120 | 0.105 | 0.095 | 0.092 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.40kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2 (g)+9H2O(l)△H=-5517.60kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5517.60kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2 (g)+18H2O(l)△H=-11035.20kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com