
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下11.2 L乙烯和丙烯的混合气体中含C-H键的数目为2NA
B. S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2NA
C. 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:选择题
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下面化学反应不符合绿色化学理念的是
A. 消除硫酸厂尾气排放:SO2 + 2NH3 + H2O ══ (NH4)2SO3
B. 治理汽车尾气中NO和CO,可利用催化装置将NO与CO转化成CO2和N2
C. 制Cu(NO3)2:Cu + 4HNO3(浓) ══ Cu(NO3)2 + 2NO2↑+ 2H2O
D. 制CuSO4:2Cu + O2  2CuO CuO + H2SO4 ══ CuSO4 + H2O
2CuO CuO + H2SO4 ══ CuSO4 + H2O
查看答案和解析>>
科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:选择题
下列做法不符合绿色化学原则的是
A. 大力开发太阳能,尽量减少化石燃料的使用
B. 对废旧电池进行回收利用
C. 农作物秸秆露天焚烧以制肥料
D. 汽车使用尾气净化装置,减少有害气体排放
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 2.3gNa完全与O2反应,失去的电子数为0.1NA
B. 0.2mol/L的NaCl溶液中含Cl-数为0.2NA
C. 7.8gNa2O2中含有的阴离子数为0.2NA
D. 标准状况下,22.4LSO3中氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol?L-1,c(Cl-)为1.3mol?L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol?L-1NaOH溶液的体积为
A. 40mL B. 72mL C. 80mL D. 128mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1 NA
D. 235g核素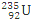 发生裂变反应:
发生裂变反应: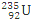 +
+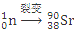 +
+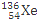 +10
+10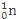 ,净产生的中子(
,净产生的中子(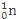 )数为10 NA
)数为10 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
B. 1 mol Na2O2固体中含离子总数为4NA
C. 1mol羟基与17 g NH3所含电子数之比为9:10
D. 一定温度下,1 L 0.5 mol·L-1NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:简答题
根据所学知识,回答相关问题:
(1)工业上以NH3作为原料制取硝酸,整个过程中涉及三个氧化还原反应,写出这三个氧化还原反应的化学方程式____________、____________、_____________
(2)硫酸具有A?D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A酸性 B吸水性 C脱水性 D强氧化性
①浓硫酸可以干燥氢气______
②浓硫酸使木条变黑______
③热的浓硫酸与铜片反应______
(3)写出足量Al与NaOH溶液反应的离子方程式为_________________,向反应后溶液中通过量CO2的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省天一大联考高三阶段性测试(四)(b卷)理综化学试卷(解析版) 题型:选择题
我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过。锂离子电池的总反应为xLi +Li1-xMn2O4 LiMn2O4,下列有关说法错误的是
LiMn2O4,下列有关说法错误的是
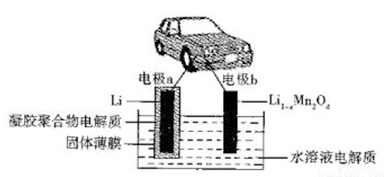
A. 放电时,Li+穿过固体薄膜进入到水溶液电解质中
B. 放电时,正极反应为Li1-xMn2O4+xLi++xe- LiMn2O4
LiMn2O4
C. 该电池的缺点是存在副反应:2Li +2H2O 2LiOH+H2↑
2LiOH+H2↑
D. 充电时,电极b为阳极,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com