
【题目】已知:还原性HSO3—>I-,氧化性IO3—>I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是( )

A.0~a间发生反应3HSO3—+IO3—===3SO42—+I-+3H+
B.a~b间共消耗NaHSO3的物质的量为1.2 mol
C.b~c间发生的反应中I2既是氧化产物又是还原产物
D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为1.08 mol
【答案】B
【解析】
原性HSO3—>I-,氧化性IO3—>I2,结合图可知,0~b无碘生成,则发生3HSO3—+IO3—==3SO42—+I-+3H+,继续加入KIO3,氧化性IO3—>I2,IO3—可以结合H+氧化I-生成I2,b~c发生IO3-+6H++5I-═3H2O+3I2。
A. 由上述分析可知,0b发生3HSO3—+IO3—===3SO42—+I-+3H+,则0a间发生反应:3HSO3—+IO3—===3SO42—+I-+3H+,与题意不符,A错误;
B. 由纵坐标可知生成碘为0.6mol,bc发生IO3-+6H++5I-═3H2O+3I2,可知b点时生成碘离子为1mol,0b消耗IO3-为1mol,0b发生3HSO3—+IO3—==3SO42—+I-+3H+,共消耗NaHSO3的物质的量为3mol,ab间共消耗NaHSO3的物质的量为3mol×![]() =1.8mol,符合题意,B正确;
=1.8mol,符合题意,B正确;
C. bc发生IO3-+6H++5I-═3H2O+3I2,只有I元素的化合价变化,I2为氧化产物也为还原反应,与题意不符,C错误;
D. 溶液中I-与I2的物质的量之比为5:2时,3HSO3-+IO3—==3SO42-+I-+3H+完全发生,反应处于bc段发生IO3-+6H++5I-═3H2O+3I2,n(KIO3)= n(I-),设生成的碘单质的物质的量为xmol,则根据反应消耗的KIO3的物质的量为![]() mol,消耗碘离子的物质的量=
mol,消耗碘离子的物质的量=![]() mol,剩余的碘离子的物质的量=(1
mol,剩余的碘离子的物质的量=(1![]() )mol,当溶液中n(I):n(I2)=5:2时,即(1
)mol,当溶液中n(I):n(I2)=5:2时,即(1![]() ):x=5:2,解得x=0.24mol,根据原子守恒加入碘酸钾的物质的量=1mol+0.24mol×13=1.08mol,与题意不符,D错误;
):x=5:2,解得x=0.24mol,根据原子守恒加入碘酸钾的物质的量=1mol+0.24mol×13=1.08mol,与题意不符,D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】下图为海水利用的部分过程。下列有关说法正确的是
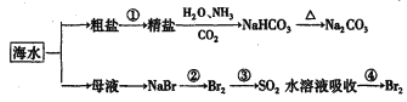
A. 粗盐提取精盐的过程只发生物理变化
B. 用澄清的石灰水可鉴别Na2CO3产品是否含有NaHCO3
C. 在第②、④步骤中,溴元素均被还原
D. 制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8 ℃,沸点44.8 ℃)的模拟装置如图所示(加热和夹持装置省略):
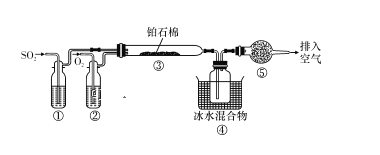
下列说法正确的是( )
A.装置①中的试剂为饱和Na2SO3溶液
B.实验室可用铜与稀硫酸在加热条件下制取SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )

A.△H2+△H3+△H4+△H5+△H6+△H7=△H1
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H5<0,在相同条件下,2Br(g)的△H5′<△H5
D.△H7<0,且该过程形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安息香酸(![]() )和山梨酸(CH3CH=CH-CH=CH-COOH)都是常用食品防腐剂。下列关于这两种酸的叙述正确的是
)和山梨酸(CH3CH=CH-CH=CH-COOH)都是常用食品防腐剂。下列关于这两种酸的叙述正确的是
A.都能使溴水褪色B.1mol酸分别与足量H2加成时消耗H2的量相等
C.安息香酸和山梨酸是同系物D.一定条件下都能与乙醇发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C、D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味。
![]()
在有机物中,凡是具有—CHO结构的物质,具有如下性质:
(1)与新制氢氧化铜悬浊液反应,产生砖红色沉淀;
(2)在催化剂作用下, —CHO被氧气氧化为—COOH,即![]() 。
。
根据以上信息及各物质的转化关系完成下列各题。
(1)B的化学式为_________,C的结构简式为__________。
(2)其中能与新制氢氧化铜悬浊液反应产生砖红色沉淀的物质有_________(填名称)。
(3)C→D的化学方程式为______________。
(4)C + E→ F的化学方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究CH3COOH的电离情况,进行了如下实验。
(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数 | 1 | 2 | 3 |
消耗NaOH 溶液的体积/mL | 20.05 | 20.00 | 19.95 |
(1)量取 20.00 mL 醋酸溶液所用的仪器是_____(填字母)
|
|
|
|
a | b | c | d |
(2)以上醋酸溶液中CH3COOH的物质的量浓度为_____
(实验二)探究浓度对CH3COOH电离程度的影响。
用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1) | 0.2000 | 0.1000 | 0.0100 |
pH | 2.83 | 2.88 | 3.38 |
(3)根据表中数据可知CH3COOH是_____电解质(填“强”或“弱”) 得出此结论的依据是_____
(4)写出CH3COOH的电离方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na2CO3 溶液加水稀释后,恢复至原温度,pH 和 Kw 均减小
B.0.1mol/L CH3COONa 溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.在 KI 溶液中加入 AgCl 固体,溶液中 c(I-)减小
D.室温下,pH=5 的 CH3COOH 溶液和 pH=5 的 NH4Cl 溶液中,溶液中 c(H+)不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com