

| A��0--b ��3HSO3�� + IO3���� 3SO4���� + I�� + 3H�� |
| B��a��ʱ����NaHSO3�����ʵ���Ϊ1��2 mol |
| C��b��ʱ�Ļ�ԭ���������KI��NaI��b~c��Ļ�ԭ������I2 |
| D������Һ��I¯��I2�����ʵ���֮��Ϊ5��2ʱ�������KIO3Ϊ1��8mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe(OH)3���������������ǻ�ԭ���� |
| B���������������� |
| C�����������Ĺ������ƺ�����ԭ���Ĺ����������ʵ���֮��Ϊ3:1 |
| D����������ֻ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe��TiO2��H2O�������йظ÷�Ӧ��˵���������(����)
Fe��TiO2��H2O�������йظ÷�Ӧ��˵���������(����)| A��FeTiO3��Fe�ԣ�2�ۣ�Ti�ԣ�4�� | B��TiO2�Ȳ�����������Ҳ���ǻ�ԭ���� |
| C����Ӧ������1 mol����ת��3 mol���� | D��FeTiO3�ڷ�Ӧ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Cu����ԭ����HNO3�������� |
| B��HNO3�ڸ÷�Ӧ��ֻ�в��ֱ��ֳ��������� |
| C��ÿ����22.4L(��״��)NO��3 mol�ĵ���ת�� |
| D�������8 mol HNO3����ԭ����������2 mol NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
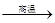 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 +8H2O������11.2LNO(��״��)����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__________��
+8H2O������11.2LNO(��״��)����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__________�� 2SO42��+I2ͨ���ı䷴Ӧ;����Fe3+��Fe2+���ɴ�������Ӧ���������ӷ���ʽ��ʾFe2+��������Ӧ�Ĵ����̣�____________________________��______________________________��
2SO42��+I2ͨ���ı䷴Ӧ;����Fe3+��Fe2+���ɴ�������Ӧ���������ӷ���ʽ��ʾFe2+��������Ӧ�Ĵ����̣�____________________________��______________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A����������Ԫ����Cu��S |
| B��MnO4����������,Cu2S�������������ǻ�ԭ�� |
| C���������뻹ԭ�������ʵ���֮��Ϊ8��5 |
| D������2.24 L(�����) SO2,ת�Ƶ��ӵ����ʵ�����0.8 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com