
ŅŃÖŖ¹¤ŅµÖĘĒāĘųµÄ·“Ó¦ĪŖCO(g) + H2O(g)  CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£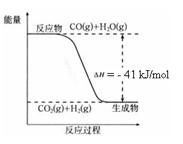
£Ø1£©Ōö¼ÓH2O(g)µÄÅØ¶Č£¬COµÄ×Ŗ»ÆĀŹ½« £ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø2£©Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K £½ ”£400 ”ꏱµÄĘ½ŗā³£ŹżK 9£ØĢī”°>”±”°<”±»ņ”±”°=”±£©”£
£Ø3£©500 ”ꏱ£¬10 minÄŚv(H2O)£½ £¬ŌŚ“Ė¹ż³ĢÖŠĢåĻµµÄÄÜĮ潫 £ØĢī”°Ōö¼Ó”±»ņ”°¼õÉŁ”±£© kJ”£
£Ø4£©ŅŃÖŖ 2H2 (g) + O2 (g) = 2H2O (g) ¦¤H£½£484 kJ/mol
½įŗĻÉĻĶ¼Š“³öCOĶźČ«Č¼ÉÕÉś³ÉCO2µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
 ĒįĖÉŹī¼Ł×Üø“Ļ°ĻµĮŠ“š°ø
ĒįĖÉŹī¼Ł×Üø“Ļ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
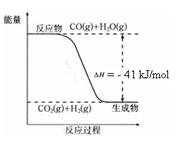
ŅŃÖŖ¹¤ŅµÖĘĒāĘųµÄ·“Ó¦ĪŖCO(g) + H2O(g) ![]() CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
£Ø1£©Ōö¼ÓH2O(g)µÄÅØ¶Č£¬COµÄ×Ŗ»ÆĀŹ½« £ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø2£©Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K £½ ”£400 ”ꏱµÄĘ½ŗā³£ŹżK 9£ØĢī”°>”±”°<”±»ņ”±”°=”±£©”£
£Ø3£©500 ”ꏱ£¬10 minÄŚv(H2O)£½ £¬ŌŚ“Ė¹ż³ĢÖŠĢåĻµµÄÄÜĮ潫 £ØĢī”°Ōö¼Ó”±»ņ”°¼õÉŁ”±£© kJ”£
£Ø4£©ŅŃÖŖ 2H2 (g) + O2 (g) = 2H2O (g) ¦¤H£½£484 kJ/mol
½įŗĻÉĻĶ¼Š“³öCOĶźČ«Č¼ÉÕÉś³ÉCO2µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ¹¤ŅµÖĘĒāĘųµÄ·“Ó¦ĪŖCO(g) + H2O(g) CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
£Ø1£©Ōö¼ÓH2O(g)µÄÅØ¶Č£¬COµÄ×Ŗ»ÆĀŹ½« £ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø2£©Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K £½ ”£400 ”ꏱµÄĘ½ŗā³£ŹżK 9£ØĢī”°>”±”°<”±»ņ”±”°=”±£©”£
£Ø3£©500 ”ꏱ£¬10minÄŚv(H2O)£½ £¬ŌŚ“Ė¹ż³ĢÖŠĢåĻµµÄÄÜĮ潫 £ØĢī”°Ōö¼Ó”±»ņ”°¼õÉŁ”±£© kJ”£
£Ø4£©ŅŃÖŖ 2H2 (g) + O2 (g) = 2H2O(g) ¦¤H£½£484kJ/mol
½įŗĻÉĻĶ¼Š“³öCOĶźČ«Č¼ÉÕÉś³ÉCO2µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2010-2011ѧğ±±¾©ŹŠ³ÆŃōĒųøßČżµŚŅ»Ń§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
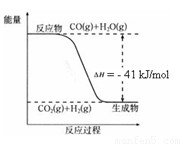
ŅŃÖŖ¹¤ŅµÖĘĒāĘųµÄ·“Ó¦ĪŖCO(g) + H2O(g)  CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2
LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
CO2(g) + H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£Źż K = 9”£ČōŌŚ2
LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0.1 mol/L£¬10 minŹ±“ļµ½Ę½ŗāדĢ¬”£
£Ø1£©Ōö¼ÓH2O(g)µÄÅØ¶Č£¬COµÄ×Ŗ»ÆĀŹ½« £ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø2£©Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K £½ ”£400 ”ꏱµÄĘ½ŗā³£ŹżK 9£ØĢī”°>”±”°<”±»ņ”±”°=”±£©”£
£Ø3£©500 ”ꏱ£¬10 minÄŚv(H2O)£½ £¬ŌŚ“Ė¹ż³ĢÖŠĢåĻµµÄÄÜĮ潫 £ØĢī”°Ōö¼Ó”±»ņ”°¼õÉŁ”±£© kJ”£
£Ø4£©ŅŃÖŖ 2H2 (g) + O2 (g) = 2H2O (g) ¦¤H£½£484 kJ/mol
½įŗĻÉĻĶ¼Š“³öCOĶźČ«Č¼ÉÕÉś³ÉCO2µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ±±¾©ĘŚÄ©Ģā ĢāŠĶ£ŗĢīæÕĢā
 CO2(g)+H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£ŹżK=9”£ČōŌŚ2LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0£®1mol/L£¬10minŹ±“ļµ½Ę½ŗāדĢ¬”£
CO2(g)+H2(g)£¬·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾”£ŌŚ500 ”ꏱµÄĘ½ŗā³£ŹżK=9”£ČōŌŚ2LµÄĆܱÕČŻĘ÷ÖŠCOŗĶĖ®ÕōĘųµÄĘšŹ¼ÅØ¶Č¶¼ŹĒ0£®1mol/L£¬10minŹ±“ļµ½Ę½ŗāדĢ¬”£ 
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com