
| A. | Al在氧气中生成Al2O3,Fe在氧气中也生成Fe2O3 | |
| B. | 第VA族氢化物的熔沸点顺序是NH3>AsH3>PH3;则第 VIA族氢化物的熔沸点顺序也是H2O>H2Se>H2S | |
| C. | 工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
分析 A.Fe在氧气中燃烧生成四氧化三铁;
B.氢化物分子的相对对分子质量越大,熔沸点越高,分子间存在氢键的沸点较高;
C.氯化铝是共价化合物熔融时不导电;
D.酸性条件下,硝酸根离子能把亚硫酸根氧化为硫酸根.
解答 解:A.Al在氧气中生成Al2O3,Fe在氧气中燃烧生成四氧化三铁不生成Fe2O3,故A错误;
B.氢化物分子的相对对分子质量越大,熔沸点越高,分子间存在氢键的沸点较高,则第VA族氢化物的熔沸点顺序是NH3>AsH3>PH3,第 VIA族氢化物的熔沸点顺序也是H2O>H2Se>H2S,故B正确;
C.氯化铝是共价化合物熔融时不导电,应该电解熔融的氧化铝来制备Al,故C错误;
D.酸性条件下,硝酸根离子能把亚硫酸根氧化为硫酸根,所以Ba(NO3)2溶液中通入SO2会生成硫酸钡沉淀,故D错误.
故选B.
点评 本题考查了元素周期律、碱金属、二氧化硫的性质、氢键等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
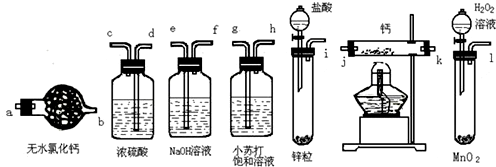
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 0.04 | B. | 0 0.04 | C. | 0.2 0.2 | D. | 0 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某品牌酱油标签的一部分:
如图为某品牌酱油标签的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com