
| A. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| B. | 液氨中含有NH3、NH4+、NH2-等粒子 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
分析 A.液氨中 c(NH4+)与 c(NH2-)的乘积只与温度有关;
B.可逆反应中的各种微粒都共存;
C.只要不破坏氨分子的电离平衡,液氨中存在c(NH4+ )=c(NH2-);
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3.
解答 解:A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中c(NH4+ )与c(NH2-)的乘积为定值,故A正确;
B.液氨电离中存在电离平衡,所以液氨中含有 NH3、NH4+、NH2-粒子,故B正确;
C.根据2NH3?NH4++NH2-知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,故C正确;
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3,所以液氨的电离达到平衡时,c(NH3)>c(NH4+)=c(NH2-),故D错误;
故选D.
点评 本题考查弱电解质的电离,为高频考点,正确理解弱电解质电离特点是解本题关键,注意液氨中 c (NH4+ )与 c (NH2- )的乘积只与温度有关,与溶液的浓度无关,易错选项是A.


科目:高中化学 来源: 题型:解答题

| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定伴随物质的状态变化 | |
| D. | 化学变化一定有新物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
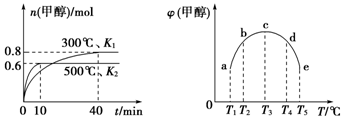
| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.01mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com