
| A. | 相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度 | |
| B. | 将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 | |
| C. | 将100mL0.10mol/L盐酸溶液分别逐滴滴入到10mL1.00 mol/L的碳酸钠溶液或10mL1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠 | |
| D. | 在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液 |
分析 A.碳酸钠的溶解度大于碳酸氢钠;
B.将石灰水加入碳酸氢钠溶液中可生成碳酸钙沉淀;
C.将100 mL 0.10 mol/L盐酸溶液逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液中生成碳酸氢钠,没有气体生成;
D.物质的量浓度相同时,碳酸根离子的水解程度大于碳酸氢根离子.
解答 解:A.向Na2CO3饱和溶液中通入CO2,会发生反应:Na2CO3+CO2+H2O=2NaHCO3↓,可证明碳酸钠的溶解度大于碳酸氢钠,故A错误;
B.NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,生成沉淀,故B错误;
C.n(HCl)=n(Na2CO3)=0.01mol,发生:H++CO32-=HCO3-,没有气体生成,故C错误;
D.Na2CO3溶液、NaHCO3溶液中,碳酸根离子和碳酸氢根离子均能水解,导致溶液显示碱性,但是碳酸根水解程度大,所以碳酸钠的碱性强于碳酸氢钠,故D正确.
故选D.
点评 本题考查Na2CO3和NaHCO3的性质,题目难度中等,注意把握Na2CO3和NaHCO3性质,明确碳酸钠和碳酸氢钠的溶解度大小、热稳定性强弱、与酸反应生成气体快慢等知识,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
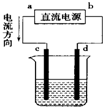
| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| B. | 浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 | |
| C. | 常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 | |
| D. | 实验室可以用浓硝酸来制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1molCu,转移2mol电子 | B. | Cu是氧化产物 | ||
| C. | Cu2S既是氧化剂又是还原剂 | D. | 氧化剂只有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
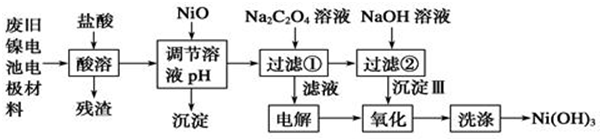
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com