
| A. | H2 | B. | NO2 | C. | NO | D. | N2O |
分析 n(Zn)=$\frac{2.6g}{65g/mol}$=0.04mol,n(HNO3)=2L×0.1mol/L=0.2mol,Zn被氧化为Zn2+,结合电子守恒计算即可.
解答 解:n(Zn)=$\frac{2.6g}{65g/mol}$=0.04mol,n(HNO3)=0.2L×0.1mol/L=0.02mol,Zn被氧化为Zn2+,HNO3的还原产物中N的化合价是x,根据电子守恒:0.04mol(2-0)=0.02mol(5-x),解得x=1,所以HNO3的还原产物中N元素是+1价,故选D.
点评 本题考查学生氧化还原反应中电子守恒的计算知识,注意知识的归纳和迁移应用是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂具有氧化性,还原剂具有还原性 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L0.5mol/L的亚硫酸溶液中含有的H+离子数为2NA | |
| B. | 2.0 gH218O和D2O的混合物中所含中子数为NA | |
| C. | 电解精炼铜时.若阳极质最减少64g,则阴极得到的电子数为2NA | |
| D. | 1L 0.1 mol/L的NaHCO3溶液中HCO3-与CO32-的离子数为0.l NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| B. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{2}{3}$ | |
| C. | 酒精着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl中含有杂质Na2SO4(硝酸钡) | |
| B. | FeSO4中含有杂质CuSO4(铁粉) | |
| C. | CO2中含有少量HCl气体(碳酸氢钠溶液) | |
| D. | CO2中含有少量的CO(灼热的氧化铜) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
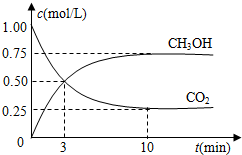
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molB+1molD | ||
| C. | 2molA+1molB+3molC | D. | 1molA+0.5molB+1.5molC+0.6molD |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com