
【题目】有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30mL盐酸恰好完全反应.试求:
(1)该白色粉末灼烧后产生气体在标准状况下的体积?
(2)原混合物中各物质的质量.
(3)所用盐酸的物质的量浓度.
【答案】
(1)解:2.00g碳酸钙的物质的量为 ![]() =0.02mol,
=0.02mol,
根据碳元素守恒可知,n(CO2)=n(CaCO3)=0.02mol,
故生成二氧化碳的体积为0.02mol×22.4L/mol=0.448L,
答:该白色粉末灼烧后产生气体在标准状况下的体积为0.448L
(2)解:加热无水碳酸钠和碳酸氢钠的混合物,
发生反应:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
由方程式可知,n(NaHCO3)=2n(CO2)=0.02mol×2=0.04mol,
故碳酸氢钠的质量为0.04mol×84g/mol=3.36g,
故碳酸钠的质量为4.42g﹣3.36g=1.06g,
答:原混合物中碳酸氢钠的质量为3.36g,碳酸钠的质量为1.06g
(3)解:原混合物中n(NaHCO3)=0.04mol,
n(Na2CO3)= ![]() =0.01mol,
=0.01mol,
灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,
根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),
根据氯离子守恒有n(HCl)=n(NaCl),
故n(HCl)=n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.01mol×2+0.04mol=0.06mol,
故盐酸的物质的量浓度为 ![]() =2mol/L,
=2mol/L,
答:盐酸的物质的量浓度为2mol/L
【解析】(1)加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成2.00g碳酸钙,根据n=
Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成2.00g碳酸钙,根据n= ![]() 计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据V=nVm计算生成的二氧化碳的体积;(2)根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;(3)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据V=
计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据V=nVm计算生成的二氧化碳的体积;(2)根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;(3)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据V= ![]() 计算需要盐酸的体积.
计算需要盐酸的体积.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: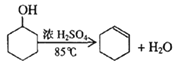


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入块状物质,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①块状物质的作用是___________,导管B的作用是___________。
②试管C置于冰水浴中的目的是____________________________________。

(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口流出,目的是_________
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______________________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 碱金属元素最外层电子数都是1个,化学性质均活泼
B. 碱金属元素从上到下随电子层数的增多金属性依次增强
C. 碱金属元素的单质都是银白色的,都比较柔软
D. 碱金属元素的单质从上到下熔沸点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL 0.5mol/L的盐酸与一块大理石反应,下列措施不能提高反应速率的是 ( )
A. 加入10mL 1mol/L的盐酸 B. 加入30mL 10mol/L的盐酸
C. 加入10mL H2O D. 所用的大理石研磨成粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝投入到一定量的NaOH溶液中,充分反应后,有2mol的电子发生了转移,则参加反应的铝的物质的量为( )
A. 1/3mol B. 1mol C. 2mol D. 2/3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油。乙醇在气缸中完全燃烧的热化学方程式为:
![]() C2H5OH(l)+
C2H5OH(l)+![]() O2(g)=CO2(g)+
O2(g)=CO2(g)+![]() H2O(l) △H1=-683.4 kJ/mol
H2O(l) △H1=-683.4 kJ/mol
下列说法正确的是
A.该反应过程中,断裂化学键会放出热量
B.该反应中,生成物的总能量大于反应物的总能量
C.乙醇的燃烧热为683.4 kJ/mol
D.反应![]() C2H5OH(l)+
C2H5OH(l)+![]() O2(g)=CO2(g)+
O2(g)=CO2(g)+![]() H2O(g)的△H2>-683.4 kJ/mol
H2O(g)的△H2>-683.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH,Au2O3 , Na2S4O6 , Na2S2O3 , Au2O,H2O.下列选项正确的是( ) ![]()
A.Na2S4O6 , H2O,Na2S2O3 , Au2O,NaOH
B.Na2S2O3 , H2O,Na2S4O6 , Au2O,NaOH
C.Na2S2O3 , NaOH,Na2S4O6 , Au2O,H2O
D.当1mol Au2O3完全反应时,转移电子的物质的量为8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不合理的是

A. 装置①:证明元素非金属性强弱 S>C>Si
B. 装置②:四氯化碳萃取碘水中的碘
C. 装置③:制备并收集少量NO气体
D. 装置④:制备少量氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com