
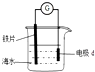
| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
分析 A、锌比铁片活泼,所以金属锌是负极;
B、d为石墨,铁片活泼,金属铁是负极;
C、d为锌块,作为负极,因海水呈中性,所以发生吸氧腐蚀;
D、海水呈中性,所以发生吸氧腐蚀.
解答 解:A、锌比铁片活泼,所以腐蚀锌,所以铁片不易被腐蚀,故A正确;
B、d为石墨,活泼金属铁片作负极,发生腐蚀,所以铁片腐蚀加快,故B错误;
C、d为锌块,作为负极,因海水呈中性,所以发生吸氧腐蚀,所以铁片上电极反应为:O2+2H2O+4e-═4OH-,故C错误;
D、海水呈中性,所以发生吸氧腐蚀,所以石墨作正极,电极反应:O2+2H2O+4e-═4OH-,故D正确;
故选D.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,难点是电极反应式的书写.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.烟花的颜色 | B.贴春联 | C.鞭炮的燃放 | D.包饺子 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
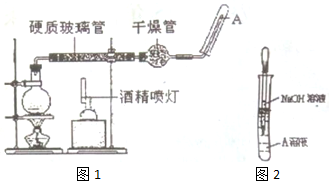
 实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀
实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com