
【题目】用如图所示装置制取表中的四种干燥、纯净的气体![]() 图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂。上述方法中可以得到干燥、纯净的气体是( )
图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂。上述方法中可以得到干燥、纯净的气体是( )
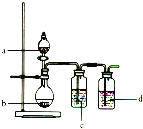
气体 | a | b | c | d |
| 稀盐酸 |
| 饱和 | 浓 |
| 浓盐酸 |
| NaOH溶液 | 浓 |
| 稀 | Cu | 品红溶液浓 |
|
| 稀盐酸 | 锌粒 | NaOH溶液 | 浓 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】一定条件下,发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
A.NH3的消耗速率等于NO的生成速率
B.NH3的消耗速率等于NO的消耗速率
C.NH3的浓度和NO的浓度都不发生改变
D.密闭容器内的压强不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
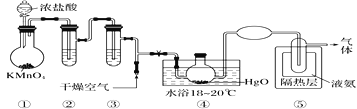
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]() Ⅰ
Ⅰ![]()
![]() 反应
反应![]() Ⅰ
Ⅰ![]() 中氧化剂是 ______ 。
中氧化剂是 ______ 。
![]() 火箭残骸中常现红棕色气体,原因为:
火箭残骸中常现红棕色气体,原因为:![]()
![]() Ⅱ
Ⅱ![]()
当温度升高时,气体颜色变深,则反应![]() Ⅱ
Ⅱ![]() 为 ______
为 ______ ![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 一定温度下,反应
一定温度下,反应![]() Ⅱ
Ⅱ![]() 的焓变为
的焓变为![]() 现将
现将![]() 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
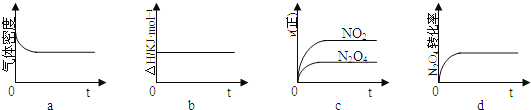
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 ______ ![]() 填“增大”、“不变”或“减小”
填“增大”、“不变”或“减小”![]() ,反应3s后
,反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 的平均反应速率
的平均反应速率 ______
![]() 。
。
![]() 硝酸厂的尾气中含
硝酸厂的尾气中含![]() 和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
![]()
![]()
则甲烷直接将![]() 还原为
还原为![]() 的热化学方程式为:_________________________________________。
的热化学方程式为:_________________________________________。
![]() 氨气在纯氧中燃烧,也可生成上述反应
氨气在纯氧中燃烧,也可生成上述反应![]() Ⅰ
Ⅰ![]() 产物中的两种.科学家利用此原理,设计成氨气
产物中的两种.科学家利用此原理,设计成氨气![]() 氧气燃料电池,则通入氨气的电极是 ______
氧气燃料电池,则通入氨气的电极是 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() ;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合H+能力的相对强弱:H2O_____NH3(填“>”、“<”或“=”);用一个离子方程式说明H3O+和NH4+给出H+能力的相对强弱_____。
(2)NaCN是离子化合物,各原子均满足8电子稳定结构。写出NaCN的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为120g·mol-1,从结构上分析其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A由两种元素组成,为探究其组成和性质,设计并完成如下实验:

(1) A的化学式为_____________________________________________________。
(2)用化学方程式表示气体C与氯水反应生成D的过程:___________________________________。
(3)B溶于盐酸后生成的物质F可用于净水,结合离子方程式说明其原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
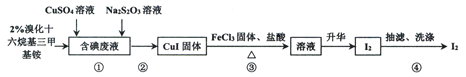
已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com