
 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C分析 (1)若D是具有氧化性的单质,A为主族的金属,钠与氧气的反应符合转化关系;
(2)若D是金属,由转化关系可知,D为变价金属,A具有强氧化性,可推知A为氯气、D为Fe、B为FeCl3、C为FeCl2;
(3)若A、B、C为含同一种金属元素的无机化合物且B不溶于水,在溶液中A和C反应生成B,应含有Al元素,可推知A为偏铝酸盐、D为强酸、B为氢氧化铝、C为铝盐(或者A为铝盐、D为强碱、B为氢氧化铝、C为偏铝酸盐).
解答 解:(1)若D是具有氧化性的单质,A为主族的金属,A为钠、D为氧气、B为氧化钠、C为过氧化钠,符合转化关系,
故答案为:Na;
(2)若D是金属,由转化关系可知,D为变价金属,A具有强氧化性,可推知A为氯气、D为Fe、B为FeCl3、C为FeCl2,则:FeCl2溶液在储存时应加入少量Fe,其理由是:加入少量铁,发生反应2Fe3++Fe=3Fe2+,防止Fe2+被氧化为Fe3+,
故答案为:2Fe3++Fe=3Fe2+;
(3)若A、B、C为含同一种金属元素的无机化合物且B不溶于水,在溶液中A和C反应生成B,应含有Al元素,可推知A为偏铝酸盐、D为强酸、B为氢氧化铝、C为铝盐(或者A为铝盐、D为强碱、B为氢氧化铝、C为偏铝酸盐),则:
B转化为C的所有可能的离子方程式为:Al(OH)3+3H+=Al3++3H2O 或Al(OH)3+OH-=AlO2-+2H2O,A与C反应的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3,
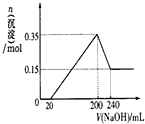
化合物Al(OH)3经过一系列反应可以得到单质E为Al,将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体,待反应完全后,向所得溶液中加入NaOH溶液,
由图可知,200~240mL为氢氧化铝与氢氧化钠反应,可知n[Mg(OH)2]=0.15mol,根据Mg元素守恒可知:m(Mg)=0.15mol×24g/mol=3.6g,
沉淀最大时为氢氧化镁、氢氧化铝,故n[Al(OH)3]=0.35mol-0.15mol=0.2mol,根据电荷守恒可知,20~200mL消耗氢氧化钠的物质的量等金属提供电子物质的量,故n(NaOH)=0.15mol×2+0.2mol×3=0.9mol,则c(NaOH)=$\frac{0.9mol}{0.2L-0.02L}$=5mol/L,
故答案为:Al(OH)3+3H+=Al3++3H2O 或Al(OH)3+OH-=AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3;3.6g;5mol/L.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,(3)中计算关键清楚个阶段发生的反应,注意利用守恒思想解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )| A. | SO2(NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com