
����Ŀ����Դ����������ͷ�չ����Ҫ֧����̼Ԫ�صĵ��ʼ������������������������Ҫ��Դ���ʣ�
��1���л���M����̫������տ�ת��ΪN��ת���������£� 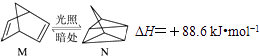
��M��N��ȣ����ȶ����� ��
��2��CO�����ںϳ�ȼ�ϼ״������д������ڵ�10L�����ܱ������г���2mol CO��4mol H2 �� �������·�Ӧ��CO��g��+2H2��g��CH3OH��g���� ���CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
���ж�������Ӧ�ﵽƽ��״̬��������������ĸ��ţ���
A��CH3OH������������CO�������������
B��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
C�����������ܶȲ���
D�������������ƽ��������������
�����д�ʩ�У���ʹ����ƽ����ϵ�� ![]() ��ֵ�������������ĸ��ţ���
��ֵ�������������ĸ��ţ���
A�������¶� B������He��g����ʹ��ϵѹǿ���� C���ٳ���1mol CO��2mol H2
��100��ʱ��Ӧ��5minĩ�ﵽƽ�⣬��ӷ�Ӧ��ʼ����ƽ�⣬v��H2��=mol/��Lmin�������¶��·�Ӧ��ƽ�ⳣ��K= �� 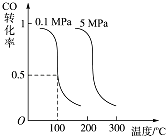
���𰸡�
��1��M
��2��BD��AC��0.04��25
���������⣺��1���л���M����̫������տ�ת��ΪN�Ĺ�ϵ��������������N�����ߣ���M���ã����ȶ��Ļ�����ΪM�� ���Դ��ǣ�M����2����CO��g��+2H2��g��CH3OH��g��������ͼ�������֪�����¶����ߣ�һ����̼ת���ʼ�С��˵��ƽ��������У�������Ӧ�Ƿ��ȷ�Ӧ��ͬ�¶���ѹǿԽ��ƽ��������У�
A��CH3OH������������CO������������ȣ�֤����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����A����
B��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯�ǻ�ѧƽ��ı�־����B��ȷ��
C��������������䣬���������������䣬���������ܶ�ʼ�ղ��䣬��������ܶȲ��䣬����˵������ƽ�⣬��C����
D�����������������䣬�����������ʵ�����С���淴Ӧ����ƽ����Է�����������������ƽ����Է����������䣬˵����Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡBD��
��A����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У���ֵ����A��ȷ��
B������He��g����ʹ��ϵѹǿ������ѹ����ѹ���䣬ƽ�ⲻ�䣬��B����
C���ٳ���1mol CO��2mol H2 �� �൱������ѹǿƽ��������У���ֵ����C��ȷ��
���Դ��ǣ�AC��
�����д������ڵ�10L�����ܱ������г���2mol CO��4mol H2 �� 100��ʱ��Ӧ��5minĩ�ﵽƽ�⣬һ����̼ת����Ϊ50%����Ӧ��һ����̼���ʵ���Ũ��Ϊ0.2��50%=0.1mol/L���������·�Ӧ�����ݻ�ѧƽ������ʽ��ʽ���㣺
CO��g��+ | 2H2��g�� | CH3OH��g�� | |
��ʼ��mol/L�� | 0.2 | 0.4 | 0 |
ת����mol/L�� | 0.1 | 0.2 | 0.1 |
ƽ�⣨mol/L�� | 0.1 | 0.2 | 0.1 |
��ӷ�Ӧ��ʼ����ƽ�⣬v��H2��= ![]() =0.04mol/Lmin��
=0.04mol/Lmin��
ƽ�ⳣ��K= ![]() =25��
=25��
���Դ��ǣ�0.04��25��
�����㾫�������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���ж϶���Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ��,�������� SO2����� SO3������Ƚ�,��ȷ��˵����
A. �ܶȱ�Ϊ 4:5 B. ���ʵ���֮��Ϊ 4:5
C. �����Ϊ 1:1 D. ԭ����֮��Ϊ 3:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ������NaOH��Һͨ��CO2���ټ��������Һ����μ���0.1mol/L�����ᣬ����CO2������������������֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
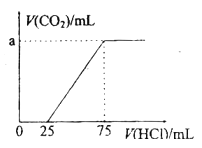
A. ԭ��Һ��NaOH�����ʵ���Ϊ0.75mol
B. ͨ��CO2�����õ���Һ���ʳɷ�ΪNaOH��Na2CO3
C. ͨ��CO2�����õ���Һ�к���2.5��10-3mol NaHCO3
D. ԭ��Һͨ��CO2��״����Ϊ112mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ӵ����ģ������ͼ��ʾ��ͼ�С���������������˫������������ͬ��ɫ���������ͬԪ�ص�ԭ�ӡ��йظ÷��ӵ�˵��������ǣ�
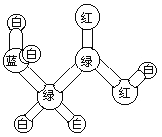
A. ���������� B. �ܷ����ۺϷ�Ӧ
C. ���������ᷴӦ D. ��������Ʒ����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��1���ֻ����1������������ӳɷ�Ӧ�������ȴ����������ȴ�����1mol����4mol����������ȫ��ȡ����Ӧ��������Ľṹ��ʽΪ��������
A.CH2�TCH2
B.CH3CH�TCH2
C.CH3CH3
D.CH2�TCHCH�TCH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.40K��40Ca����ͬ��������B.H2��D2��Ϊͬλ��
C.S2��S8��ͬ��������D.16O3��Ħ��������48
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У����ǻ��������ָ����Ļ�ѧ��Ӧ���밴Ҫ��ش���������:
��1�����Ӹ���ʱ���õĺ�ҩΪ�Ȼ�泥����������������Ӵ������⡣�����ķ�Ӧ��ϵ�й����������ʣ�NH4Cl��N2��Fe2O3��Fe��FeCl3 �� X��
�ٸ������⣬���жϳ�X��_____________��д��ѧʽ��
��д������ƽ�÷�Ӧ�Ļ�ѧ����ʽ������˫���ű������ת�Ƶķ������Ŀ��______��
��2����Ԫ������Ȼ���к������ĵĽ���Ԫ�أ�Ӧ�ù㷺���������������ᷴӦ������ǿ�Ӧ����д������ǿ�Ӧ�����ӷ���ʽ__________________________________________ ��
��3��Na2O2������������ߵĹ������� ������Ӧ�Ļ�ѧ����ʽΪ__________________________��
��4����ˮ���������ڱ�¶�ڿ����л���ʣ�������Ϊ��ˮ�����������������������̼�Ӵ������������ɫ������״������Ե�ʡ�д����Ӧ�����ӷ���ʽ_________________________________��
��5��С�մ����θҩ����д�����к�θ��ʱ�����ӷ���ʽ______________________ ��
��6���ڷ�Ӧ 3BrF3+5H2O = HBrO3+Br2+9HF+O2 �У���������Ԫ����____________������5 molˮ��Ӧʱ����H2O��ԭ��BrF3Ϊ______________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ԭ�ӽṹ����ʶ��������ģ�����ԭ�ӽṹģ�������н�ʵ�ʵ���
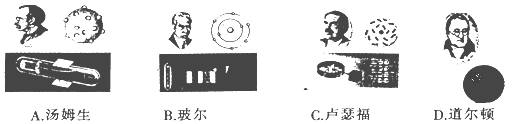
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�PM 2.5��SO2��NOx�ȣ��Լ���������������Ҫ���壮ȡij����������ˮ�����Ƴɴ���Һ�������������ӵĻ�ѧ��ּ���Ũ�����±���
���� | K+ | Na+ | NH4+ | H+ | SO42�� | NO3�� | Cl�� |
Ũ��/molL��1 | 4��10��6 | 6��10��6 | 2��10��5 | a | 2��10��5 | 3��10��5 | 2��10��5 |
��ش��������⣺
��1�����ݱ������ݼ���˴���Һ��c��H+��Ũ��aΪ________mol/L��
��2��NOx������β���е���Ҫ��Ⱦ��֮һ��
����������������ʱ�ĸ��»�����N2��O2��Ӧ����Ӧ�Ļ�ѧ����ʽ��__________��
��NOx���γ����꣬��NO2�γ��������Ҫ��Ӧ��______________��д��ѧ����ʽ����
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
����ȼú�м�����ʯ�ҿ�����������ã�SO2�����պ�ת����һ����Ԫ�ص����̬�Ļ�����û����ﳣ��Ϊ����������ԭ�ϣ����ڶ��������е�������___________��
�����������е�SO2���������ʿ������ռ�����_______������ţ���
a��NaOH b��H2SO4 c��NaHSO3 d. Na2SO3
���Ṥҵ�е�β��SO2����ѭ�����ã�д��SO2ת��ΪSO3��Ӧ�Ļ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com