
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移的电子数目是0.8NA | |
| C. | 1L 1mol/L的K2CO3溶液中离子总数小于3NA | |
| D. | 室温下,42.0g 乙烯和丙烯的混合气体中含有的碳原子数为3NA |
分析 A.气体状况未知;
B.Na2O2与H2O的反应是歧化反应,过氧化钠既是氧化剂又是还原剂;
C.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
D.因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,然后计算.
解答 解:A.气体状况未知,无法计算气体的体积,故A错误;
B.Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故B错误;
C.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,1L 1mol/L的K2CO3溶液中离子总数大于3NA,故C错误;
D.因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,n(C)=$\frac{42g}{14g/mol}$=3mol,混合气体中含有的碳原子数为3NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关判断,做题时注意物质的聚集状态、存在条件、物质的组成、结构和性质等知识,题目难度不大.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| B. | 工业燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若同时使用硫酸亚铁和氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 航天服的主要成分是碳化硅、陶瓷和碳纤维,它们都属于无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
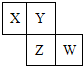 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 非金属性:W>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:X>Y>Z | |
| D. | 最高正化合价:W>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | 单位时间里每增加1molN2,同时减少2mol NH3 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com