
分析 根据n=$\frac{V}{Vm}$计算HCl的物质的量,根据m=nM计算HCl的质量,由m=ρV计算水的质量,HCl的质量分数=$\frac{m(HCl)}{m(HCl)+m(水)}$×100%;再根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算所得溶液的物质的量浓度;根据稀释前后溶质的物质的量不变来计算;根据容量瓶使用前必须进行检查是否漏水;分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:HCl的物质的量n(HCl)=$\frac{448L}{22.4L/mol}$=20mol,溶液的质量=m(HCl)+m(H2O)=20mol×36.5 g/mol+1000g=1730g,故溶液质量分数=$\frac{20mol×36.5g/mol}{1730g}$×100%=42.2%;
溶液体积V=$\frac{1730g}{1.21g/c{m}^{3}}$=1.43L,c(HCl)=$\frac{20mol}{1.43L}$=13.99mol/L,
配制后的稀溶液中含HCl物质的量浓度为C,则有:10mL×13.99mol/L=250mL×C,解得:C=0.56mol/L;
在用浓盐酸配制上述稀盐酸时,所用仪器中使用前必须检查是否漏液的仪器是250mL容量瓶;
A、容量瓶蒸馏水洗后未加干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故A不选;
B、量筒用蒸馏水洗后未干燥就用来量取浓盐酸,导致浓盐酸浓度降低,量取的浓盐酸中含有溶质的物质的量偏小,溶液浓度偏低,故B选;
C、用量筒量取浓盐酸时俯视读数,导致量取浓盐酸体积偏小,氯化氢的物质的量偏小,溶液浓度偏低,故C 选;
D、将烧杯中浓盐酸转移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故D选;
E、用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故E选;
F、定容时,俯视液面加水至刻度线,导致溶液体积偏小,溶液浓度偏高,故F不选;
G、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故G选;
故选:B C D E G
故答案为:42.2%;13.99mol/L;0.56mol/L;250mL容量瓶;B C D E G;
点评 本题考查物质的量浓度、质量分数的有关计算和一定物质的量浓度溶液的配制及误差分析等,明确相关计算公式,熟悉配制一定物质的量浓度溶液原理及操作步骤是解题关键,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
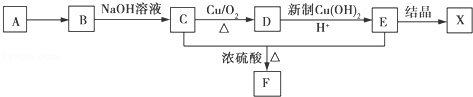
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
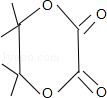
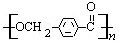 的路线:
的路线: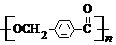
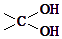 →
→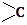 ═O+H2O
═O+H2O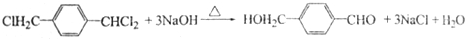 ;该反应过程中生成的不稳定中间体的结构简式应是
;该反应过程中生成的不稳定中间体的结构简式应是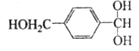 .
.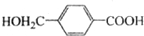 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式:
,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式: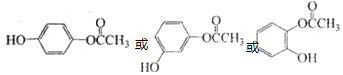 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)和c(H+)都减小 | B. | 溶液的PH增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 跟水反应时,水作氧化剂 | B. | NaH在水中显酸性 | ||
| C. | 跟液氨反应时,有NaNH2生成 | D. | 跟乙醇反应时,NaH被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com