
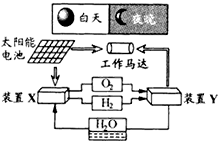
 (2010?江苏)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
(2010?江苏)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )

科目:高中化学 来源: 题型:阅读理解
 (2010?江苏二模)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
(2010?江苏二模)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.| 25 |
| 2 |
| 25 |
| 2 |
| 放电 |
| 充电 |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c (02)/mol?L-1 | c (C02)/mol?L-1 | v(正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com