
| n |
| V |
| 0.15mol |
| 0.2L |
|


科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
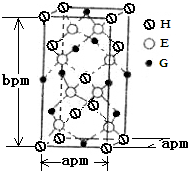 A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:
A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCN |
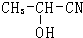
| HCl |
| H2O |
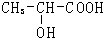
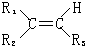
| ①O5 |
| ②Zn/H2O |
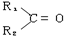 +
+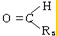
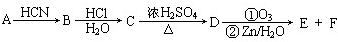
查看答案和解析>>
科目:高中化学 来源: 题型:
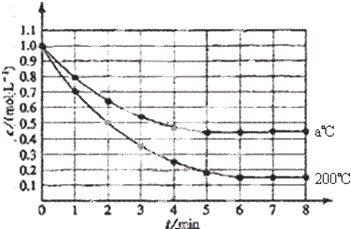
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com