
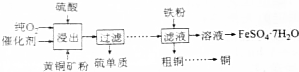
���� ��1��CuFeS2��ͭ�Ļ��ϼ�Ϊ+2�ۣ���Ϊ-2�ۣ�����Ԫ�ػ��ϼ۴�����Ϊ��ȷ�����Ļ��ϼۣ�
��2��Ҫ����Һ�еõ��̷�������ͨ������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ�����Ȳ��裻
��3������������ˮ�⣬����������������ҺʱҪ��ֹ��������ˮ�⣻
��4���ٸ�������ʵ�鲽���֪���ζ�ʵ��ﵽ�յ�ʱ����Һ�еĸ�����ز���ȫ��ɫ����Һ��dz��ɫ��
������KMnO4��FeSO4��ԭʱ����Mn2+��ͬʱ���������ӣ����ݵ���غ��Ԫ���غ���д���ӷ���ʽ��
�۸��ݵ��ӵ�ʧ�غ��й�ϵʽMnO4-��5Fe2+���ζ�����ȥ�ĸ�����ص����ʵ���Ϊ0.0100mol/L��0.04L=0.0004mol������6.000g�̷���Ʒ��FeSO4•7H2O�����ʵ���Ϊ$\frac{250}{25}$��5��0.0004mol=0.02mol���ݴ˼�����Ʒ��FeSO4•7H2O������������
��5����ͭ��⾫����������������ͭ���ӵõ�������ͭ���ʣ�
��� �⣺��1��CuFeS2��ͭ�Ļ��ϼ�Ϊ+2�ۣ���Ϊ-2�ۣ�����Ԫ�ػ��ϼ۴�����Ϊ��ɺ����Ļ��ϼ�Ϊ+2�ۣ�
�ʴ�Ϊ��+2��
��2��Ҫ����Һ�еõ��̷�������ͨ������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ�����Ȳ��裬����ʵ����������Ϊbcae��
�ʴ�Ϊ��bcae��
��3������������ˮ�⣬����������������ҺʱҪ��ֹ��������ˮ�⣬���Խ��̷�����һ��Ũ�ȵ������п���������������ˮ�⣬
�ʴ�Ϊ��������������ˮ�⣻
��4���ٸ�������ʵ�鲽���֪���ζ�ʵ��ﵽ�յ�ʱ����Һ�еĸ�����ز���ȫ��ɫ����Һ��dz��ɫ�������жϵζ�ʵ��ﵽ�յ�������ǵμ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��
�ʴ�Ϊ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��
������KMnO4��FeSO4��ԭʱ����Mn2+��ͬʱ���������ӣ���Ӧ�����ӷ���ʽΪMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ʴ�Ϊ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�۸��ݵ��ӵ�ʧ�غ��й�ϵʽMnO4-��5Fe2+���ζ�����ȥ�ĸ�����ص����ʵ���Ϊ0.0100mol/L��0.04L=0.0004mol������6.000g�̷���Ʒ��FeSO4•7H2O�����ʵ���Ϊ$\frac{250}{25}$��5��0.0004mol=0.02mol��������Ʒ��FeSO4•7H2O����������Ϊ$\frac{0.02��278}{6.000}$��100%=92.67%��
�ʴ�Ϊ��92.67%��
��5����ͭ��⾫����������������ͭ���ӵõ�������ͭ���ʣ��缫��ӦʽΪCu2++2e-�TCu��
�ʴ�Ϊ��Cu2++2e-�TCu��
���� ���⿼�黯ѧ�������̡����ʵķ����ᴿ��������ԭ�ζ�Ӧ�á����ԭ���ȣ����ʵ��ԭ���ǽ���Ĺؼ�����Ҫѧ���߱���ʵ�Ļ���֪ʶ���ۺ�����֪ʶ�������⡢���������������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2�ͳ���ʯ��ˮ��Ӧ��Cl2+2OH-�TCl-+ClO-+H2O | |
| B�� | NaHCO3��Һ��NaOH��Һ��Ӧ��OH-+HCO3-�TCO2��+H2O | |
| C�� | ��AlCl3��Һ�м�������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| D�� | ʵ�����ô���ʯ��ϡ������ȡCO2��CaCO3+2H+�TCa2++CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
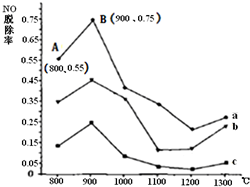 ����[CO��NH2��2]��һ������������Ч��NOת��ΪN2����ͼΪCO��NH2��2��ij����������ҪΪN2��NO����NO�����ʵ�����ֵ�ֱ�Ϊ1��2��2��1��3��1ʱ��NO�ѳ��ʣ�NO����������NO��ԭʼ���ı�ֵ�����¶ȱ仯������ͼ��
����[CO��NH2��2]��һ������������Ч��NOת��ΪN2����ͼΪCO��NH2��2��ij����������ҪΪN2��NO����NO�����ʵ�����ֵ�ֱ�Ϊ1��2��2��1��3��1ʱ��NO�ѳ��ʣ�NO����������NO��ԭʼ���ı�ֵ�����¶ȱ仯������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
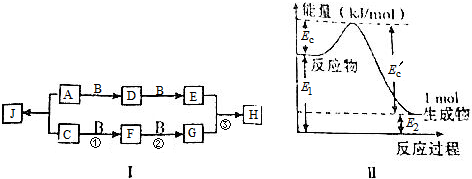
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ��Ӧ�� | �� | �� | �� |
| A | 2 | 1 | 1 |
| B | 1 | 2 | 1 |
| A�� | A��ת���ʼף������� | B�� | A��ת���ʼף��ң��� | ||
| C�� | B ��ת���ʼף������� | D�� | B��ת���ʼף��ң��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.44s | B�� | 1s | C�� | 7.33s | D�� | 2s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڿ������п������ƣ���������䰵��2Na+O2�TNa2O2 | |
| B�� | ���Ȼ�����Һ�м��������ˮ��������ɫ������Al3++3OH-�TAl��OH��3�� | |
| C�� | ��������ˮ�������ȣ��������壺2Fe+3H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+3H2 | |
| D�� | ��Ͷ�뵽ˮ�У��������壺2Na+2H2O�T2NaOH+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��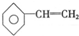 �� E��
�� E��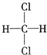 ��
��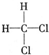 �� F��
�� F��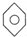 ��
��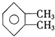 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com