
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)配制一定物质的量浓度硫酸溶液的一般步骤有:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,据此排序;
(3)容量瓶为配制特定体积的一定物质的量浓度溶液的专用仪器,不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(4)①依据C=$\frac{1000ρω}{M}$浓硫酸的物质的量浓度;根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)硫酸的浓度越大密度越大,该硫酸与等质量的水混合,质量变为2倍,密度降低,体积比原浓硫酸的2倍大,结合稀释定律判断.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、250ml容量瓶,所以还缺少的仪器:250mL容量瓶;
故答案为:250mL容量瓶;
(2)配制一定物质的量浓度硫酸溶液的一般步骤有:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为:AEFDCB;
故答案为:AEFDCB;
(3)容量瓶只能用来配制特定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选CDE;
故答案为:CDE;
(4)①质量分数98%密度为1.84g•cm-3浓H2SO4的物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
设需要浓硫酸溶液的体积为V,则根据溶液稀释前后溶质的物质的量不变:1.0mol•L-1×250ml=V×18.4mol/L,解得:V=13.6ml;
故答案为:13.6;
②将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌,若搅拌过程中有液体溅出,导致溶质硫酸的物质的量偏小,会使最终结果 偏低;
若将量筒洗涤转移到容量瓶,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高;
定容时水加多后用滴管吸出,导致;溶质硫酸的物质的量偏小,会使最终结果 偏低;
故答案为:偏低; 偏高;偏低;
(5)硫酸的浓度越大密度越大,该硫酸与等质量的水混合,质量变为2倍,密度降低,体积比原浓硫酸的2倍大,根据稀释定律,稀释前后溶质硫酸的物质的量不变,所以浓度小于原浓硫酸的$\frac{1}{2}$,混合所得溶液的物质的量浓度小于9.2 mol/L,
故答案为:<.
点评 本题考查物质的量浓度的计算、物质的量浓度与质量分数的关系等,难度中等,注意硫酸溶液的密度与浓度的关系,硫酸的浓度越大密度越大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性 | |
| C. | 在相同浓度的盐酸中,纯铁比含碳量较高的生铁反应速率快 | |
| D. | 冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
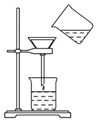 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Fe2+、NH4+、SO42-、S2-可以大量共存 | |
| B. | 该溶液中,H+、K+、NO3-、SO42-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓硫酸,反应的离子方程式为:ClO2-+4H++3 Cl-=2Cl2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
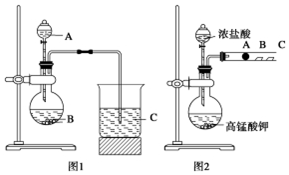
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com