
分析 (1)根据n=$\frac{m}{M}$计算二氧化锰的物质的量;
(2)发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据方程式计算生成氯气的物质的量,再根据V=nVm计算氯气体积;
(3)作还原剂的盐酸转化为氯气,根据氯原子守恒计算.
解答 解:(1)8.7g 二氧化锰的物质的量为$\frac{8.7g}{87g/mol}$=0.1mol,
答:二氧化锰的物质的量为0.1mol;
(2)设生成氯气的物质的量为n,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 1mol
0.1mol n
所以1mol:1mol=0.1mol:n
解得n=0.1mol
则标况下氯气体积为0.1mol×22.4L/mol=2.24L
答:标况下生成氯气的体积为2.24L.
(3)作还原剂的盐酸转化为氯气,根据氯原子守恒,反应中作还原剂的盐酸的物质的量为0.1mol×2=0.2mol,
答:反应中作还原剂的盐酸的物质的量为0.2mol.
点评 本题考查化学方程式计算、氧化还原反应计算、物质的量有关计算等,题目贴近教材,比较基础,有利于基础知识的巩固.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
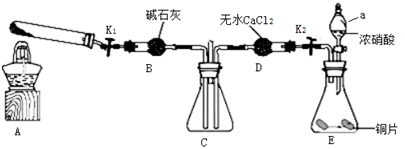
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 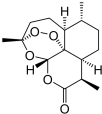 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
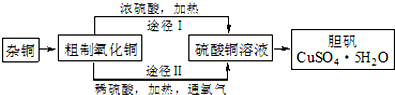
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com