
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
分析 A.没有告诉二氧化碳和二氧化硫的物质的量,无法计算二者含有的氧原子数目;
B.常温下pH=13的溶液中氢氧根离子浓度为0.1mol/L,根据n=cV计算出该溶液中含有的氢氧根离子数目;
C.根据铁与水蒸气反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2计算;
D.铵根离子浓度不同,在溶液中的水解程度不同.
解答 解:A.题中数据无法计算CO2和SO2的物质的量,则无法计算含有的氧原子数目,故A错误;
B.25℃时,pH=13的1.0L Ba(OH)2溶液中,氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故B正确;
C.Fe粉与足量水蒸气反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,所以0.10molFe粉与足量水蒸气反应生成的H2分子数为:$\frac{0.4}{3}$NA,故C错误;
D.1L 1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含溶质氯化铵的物质的量都是1mol,由于两溶液中铵根离子的浓度不同,则铵根离子的水解程度不同,所以两溶液中含有的NH4+数目不同,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,A为易错点,注意题中条件无法计算二氧化碳和二氧化硫的物质的量.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
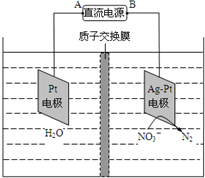 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )| A. | 14.4 | B. | 10.4 | C. | 12.4 | D. | 14.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
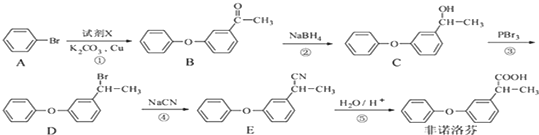
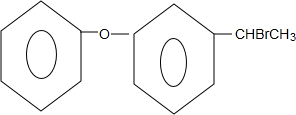 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$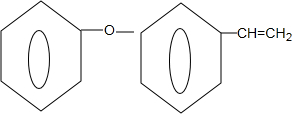 +NaBr+H2O.
+NaBr+H2O.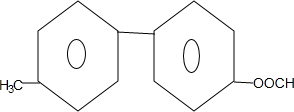 .
.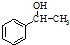 为原料制备
为原料制备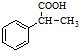 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;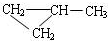 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.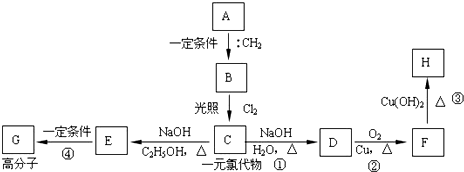
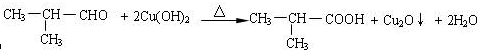 ;
; .
.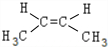 、
、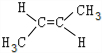 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧反应的发生一定要用火去引燃 | |
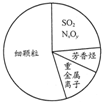
| B. | 右图为雾霾的主要成分示意图,其中SO2和NxOy都属于酸性氧化物,重金属离子可导致蛋白质变性 | |
| C. | 塑料、合成橡胶和合成纤维是我们熟悉的三大合成材料,它们都是以石油、煤和天然气为原料生产的 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
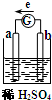 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com