
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是
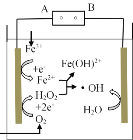
A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
【答案】D
【解析】
根据图示,三价铁离子在左端电极得到电子转化为亚铁离子,发生还原反应,左端电极为阴极,则A为电源负极,B为电源正极,右端电极为阳极。
A. 根据上述分析,电源的A极为负极,故A正确;
B. 与电源B极相连电极为阳极,根据图示,水在阳极上失电子产生羟基自由基(·OH),电极反应式为H2O-e- =H++·OH,故B正确;
C. 电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH),由图示装置可知,H2O-e- =H++·OH,Fe3++e-=Fe2+,O2+2e- +2H+=H2O2;则H2O2+Fe2+ =Fe(OH)2++·OH, Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH,故C正确;
D. D.每消耗1 mol O2,转移4 mol电子,根据H2O2+Fe2+ =Fe(OH)2+ +·OH反应看出转移1 mol电子,生成1mol·OH ,所以应当生成4 mol·OH,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O
B. Fe2 (SO4) 3溶液和H2S反反应的离子方程式:2Fe3++H2S=FeS+2H+
C. NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
D. 往NH4HCO3溶液中加过量的NaOH溶液并加热:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是

A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含有_____个硫原子,_____mol O。
(2)写出下列物质在水溶液中的电离方程式
HCl:_______________NaHSO4:____________________
(3)写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式_________________
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式____________________
印刷电路板处理时铜与氯化铁溶液反应的离子方程式_______________________
(4)配平下列方程式:
_____I-+_____IO3-+ _____H+—_____I2+_____H2O
_____NH4ClO4——_____N2↑+_____O2↑+_____HCl+_____H2O
(5)用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O__________________
HNO3的作用是__________,发生氧化反应,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
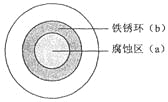
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:

对上述流程中的判断正确的是
A. 试剂X为稀硫酸
B. 结合质子( H+)的能力由强到弱的顺序是:AlO2—> OH— >CO32—
C. 反应II中生成Al(OH)3的反应为:CO2+AlO2- +2H2O =Al(OH)3↓+HCO3-
D. Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。

(1)X元素在元素周期表中的位置________。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________(用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________(用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________。关于该电池的下列说法,正确的是_________。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______+______MnO4- + ________H+ = ______CO2 + _______Mn2++______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
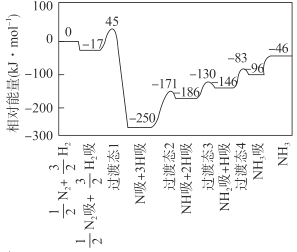
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com