
 ��
������ A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ�A��B��ɵij����������ʹʪ��ĺ�ɫʯ����ֽ���������ΪNH3��AΪH��BΪNԪ�أ�A��C����ͬһ���壬���ԭ��������֪��CΪNa��C��D��E����ͬһ���ڣ�Ӧ�ô��ڵ������ڣ�Eԭ�ӵ�������������A��B��Cԭ������������֮�ͣ���Eԭ������������Ϊ��1+1+5=7����EΪCl��E�ĵ���������ף�NH3����Ӧ������B�ĵ��ʣ�ͬʱ������������ˮ�������ԵĻ������Һͱ���Ӧ��Ϊ�Ȼ�狀��Ȼ��⣬����0.1mol/L������ҺpH��1������ΪNH4Cl����ΪHCl��D�ĵ��ʼ�����C��Na��Ԫ������������ˮ�������Һ������������Һ����Ӧ�����ζ���Ҳ�������HCl����ˮ��Һ��Ӧ�������죬��D����������Ϊ�������������DΪAlԪ�أ��ʶ�ΪNaAlO2����Ϊ�Ȼ������ɴ˷������
��� �⣺A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ�A��B��ɵij����������ʹʪ��ĺ�ɫʯ����ֽ���������ΪNH3��AΪH��BΪNԪ�أ�A��C����ͬһ���壬���ԭ��������֪��CΪNa��C��D��E����ͬһ���ڣ�Ӧ�ô��ڵ������ڣ�Eԭ�ӵ�������������A��B��Cԭ������������֮�ͣ���Eԭ������������Ϊ��1+1+5=7����EΪCl��E�ĵ���������ף�NH3����Ӧ������B�ĵ��ʣ�ͬʱ������������ˮ�������ԵĻ������Һͱ���Ӧ��Ϊ�Ȼ�狀��Ȼ��⣬����0.1mol/L������ҺpH��1������ΪNH4Cl����ΪHCl��D�ĵ��ʼ�����C��Na��Ԫ������������ˮ�������Һ������������Һ����Ӧ�����ζ���Ҳ�������HCl����ˮ��Һ��Ӧ�������죬��D����������Ϊ�������������DΪAlԪ�أ��ʶ�ΪNaAlO2����Ϊ�Ȼ�����
��1�������������Ļ�ѧʽΪNH3��B����ΪN2������ʽΪ ���ʴ�Ϊ��NH3��
���ʴ�Ϊ��NH3��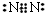 ��
��
��2��DԪ�ص������������ʴ�Ϊ������
��3��NaAlO2��Һ��ͨ�����������̼����Ӧ��������������̼�����ƣ����ӷ���ʽΪAlO2-+CO2 ������+2H2O=Al��OH��3+HCO3-���ʴ�Ϊ��AlO2-+CO2 ������+2H2O=Al��OH��3+HCO3-��
��4��N2 +3H2?2NH3 ��H��0
��ʼ��mol����2 1.6 0
��Ӧ��mol����0.4 1.2 0.8
ƽ�⣨mol����1.6 0.4 0.8
ƽ�ⳣ��K=$\frac{{{{��\frac{0.8mol}{2L}��}^2}}}{{\frac{1.6mol}{2L}��{{��\frac{0.4mol}{2L}��}^3}}}$=25���ʴ�Ϊ��25��
��5�������백����Ӧ����NH4Cl��HCl���������ʵ���֮��Ϊ2��4����÷�Ӧ����ʽΪ��3Cl2+4NH3=N2+2NH4Cl+4HCl���÷�Ӧ�б��������ǰ���������ԭ��Ϊ������������ȫ����ԭ����4mol��������2mol�����������Ը÷�Ӧ�б������������뱻��ԭ�����ʵ����ʵ���֮��Ϊ2��3���ʴ�Ϊ��2��3��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɣ�Ԫ�ص��ƶ��ǽ������ѵ㣬ע������ʽ�ڽ�ƽ�ⳣ�������ϵ�Ӧ�ã�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NA��HCl������44.8 L H2��Cl2�Ļ������������ԭ����Ŀ��Ϊ4NA | |
| B�� | 32gCu������Ũ��ϡ����ֱ�ԭΪNO2��NO��Ũ��ϡ����õ��ĵ�������ΪNA | |
| C�� | ���ʵ���Ũ�Ⱦ�Ϊ1mol/L��NaCl��MgCl2�����Һ�У�����Cl-����ĿΪ3NA | |
| D�� | 1molD3${\;}_{\;}^{18}$O+������D����${\;}_{1}^{2}$H���к��е�������Ϊ10NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgI����Һ�д���ƽ�⣺AgI��s��?Ag+��aq��+I-��aq�� | |
| B�� | 25��ʱ����AgCl������Һ�м���NaCl���壬AgCl���ܶȻ��������� | |
| C�� | ��KCl��NaI�Ļ����Һ�е���AgNO3��Һ��һ��������AgI���� | |
| D�� | �õ������ˮ���Ȼ�����Һ�ֱ�ϴ��AgCl������ˮϴ��ɵ�AgCl��Ĵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�����ڱ��в�õ����ԭ������Ϊͬʹ�ص����ԭ������ | |
| B�� | ��ѧ���ı仯һ��������ѧ��Ӧ�ı仯 | |
| C�� | ����������һ���Ƿǽ��������� | |
| D�� | �����ں�ˮ�б��ں�ˮ�и���ʴ����Ҫԭ���Ǻ�ˮ���������ں�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ�����м���ͭ�ۣ��ټ���KNO3���� | |
| B�� | SO2ͨ��Ba��NO3��2��Һ�� | |
| C�� | CO2ͨ��CaCl2��Һ�� | |
| D�� | ϡ����μӵ�Fe��OH��3������Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
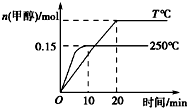 ��1mol CO��2mol H2����һ�ݻ�Ϊ1L���ܱ������У��ֱ���250�桢T�淢����Ӧ��CO��g��+2H2��g��?CH3OH��g����H=a kJ/mol������ͼʾ�жϣ����н�����ȷ���ǣ�������
��1mol CO��2mol H2����һ�ݻ�Ϊ1L���ܱ������У��ֱ���250�桢T�淢����Ӧ��CO��g��+2H2��g��?CH3OH��g����H=a kJ/mol������ͼʾ�жϣ����н�����ȷ���ǣ�������| A�� | a��0��T��250 | |
| B�� | 250��ʱ��0��10 min��v��H2��=0.015 mol/��L•min�� | |
| C�� | CO��ƽ��ת������250��ʱ��T��ʱ�� | |
| D�� | 250��ʱ����ʼʱ�������иij�1 mol CH3OH���壬���´�ƽ���CH3OH�����ʵ�������0.15 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com