
| 4.1×10-15 |
| 0.1 |
| KSP |
| c(Cl-) |
| 1.6×10-10 |
| 0.1 |
| 4.1×10-15 |
| 1×10-5 |
| 1.5×10-16 |
| 1×10-5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl-+2Fe3+ |
| B、大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| D、为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用来净水却不能降低水的硬度,其净水原理是:KAl(SO4)2═K++Al3++SO42-;Al3++3H2O?Al(OH)3(胶体)+3H+ |
| B、在粗铜的电解精炼中,粗铜为电解池的阴极,纯铜为电解池的阳极 |
| C、某硅酸盐Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO?5MgO?8SiO2?H2O |
| D、若火箭推进器中发生:H2N-N(CH3)2+2N2O4═3N2+2CO2+4H2O反应.则每生成3mol 氮气,转移电子的物质的量为16mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
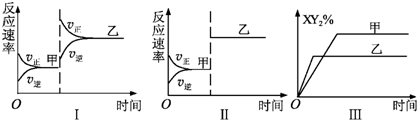
| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、柠檬酸的电离会抑制碳酸的电离 |
| B、该碳酸饮料中水的电离受到抑制 |
| C、常温下,该碳酸饮料中KW的值大于纯水中KW的值 |
| D、打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com