
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

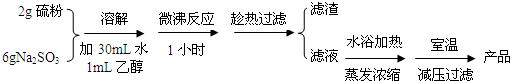
分析 (1)用硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O,在反应后的混合物中要除去固体杂质,使Na2S2O3•5H2O留在滤液中,所以要趁热过滤,减少海波的损失;
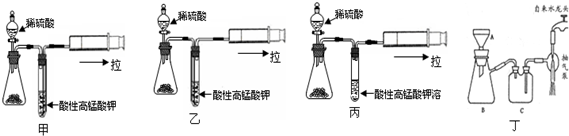
(2)海波易溶于水,不溶于乙醇,硫代硫酸钠能与硫酸反应,所以洗涤液采用乙醇,而不用蒸馏水或稀硫酸,根据丁图可知,该装置是抽滤的装置,根据抽滤的操作答题;
(3)淀粉溶液作为指示剂,终点时溶液中出现碘单质,所以溶液由无色变为蓝色;
(4)根据反应I2+2S2O32-═2I-+S4O62-,由碘的物质的量计算出海波的物质的量,进而计算出海波的质量,根据纯度=$\frac{海波的质量}{样品的质量}$×100%计算;
(5)A.锥形瓶未干燥,对实验结果没有影响;
B.滴定管经水洗后末用标准液润洗,标准液被稀释,浓度下降;
C.滴定前平视,滴定后仰视,读出来的数据比实际数据大;
D.滴定前,滴定管中的液面处于“0”刻度以下,对实验结果没有影响;
(6)探究化学反应速率的影响因素,只能改变一个条件,其他条件要相同,做对比实验,据此判断;
(7)检验实验过程中产生的SO2气体,可以使二氧化硫气体通过高锰酸钾溶液,在图中装置里,二氧化硫气体应从长导管进入高锰酸钾溶液,据此选择,二氧化硫与高锰酸钾反应生成硫酸根离子与锰离子.
解答 解:(1)用硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O,在反应后的混合物中要除去固体杂质,使Na2S2O3•5H2O留在滤液中,所以要趁热过滤,减少海波的损失,
故答案为:防止温度降低时海波的析出,以减少海波的损失;
(2)海波易溶于水,不溶于乙醇,硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O),所以洗涤液采用乙醇,而不用蒸馏水或稀硫酸,根据丁图可知,该装置是抽滤的装置,所以对海波晶体洗涤的方法是关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体,
故答案为:海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O);关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体;
(3)淀粉溶液作为指示剂,终点时溶液中出现碘单质,所以溶液由无色变为蓝色,所以判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色,
故答案为:当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色;
(4)根据反应I2+2S2O32-═2I-+S4O62-,反应中碘的物质的量为cV×10-3mol,所以海波的质量为2×cV×10-3mol×248g/mol,所以纯度=$\frac{2×cV×10{\;}^{-3}×248g}{ag}$×100%=$\frac{49.6cV}{a}$%,
故答案为:$\frac{49.6cV}{a}$%;
(5)A.锥形瓶未干燥,对实验结果没有影响,故A不选;
B.滴定管经水洗后末用标准液润洗,标准液被稀释,浓度下降,用掉的标准液的体积偏大,导致滴定结果偏高,故B选;
C.滴定前平视,滴定后仰视,读出来的数据比实际数据大,导致滴定结果偏高,故C选;
D.滴定前,滴定管中的液面处于“0”刻度以下,对实验结果没有影响,故D不选;
故选BC;
(6)探究化学反应速率的影响因素,只能改变一个条件,其他条件要相同,做对比实验,通过比较表中四组数据可知,比较①③或②④可得出温度对反应速率的影响,比较③④或①②可得浓度对反应速率的影响,所以能够得出反应速率影响因素的实验组合有4组,
故答案为:4;
(7)检验实验过程中产生的SO2气体,可以使二氧化硫气体通过高锰酸钾溶液,在图中装置里,二氧化硫气体应从长导管进入高锰酸钾溶液,所以选择乙装置,反应的离子方程式为,
故答案为:乙;5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查了物质制备实验探究,物质性质和生产流程中发生的化学反应的分析判断,实验基本操作的灵活运用及样品纯度的计算为解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径都在1~100nm之间 | B. | 均能产生丁达尔效应 | ||
| C. | 用漏斗过滤时滤纸上没有滤渣留下 | D. | 均呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、SO2、SiO2、NO | B. | 盐:Na2CO3、KHCO3、Cu2(OH)2CO3 | ||
| C. | 非电解质:酒精、蔗糖、氨气、次氯酸 | D. | 混合物:液氯、盐酸、胆矾、氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| D | ZnSO4(CuSO4) | Zn(OH)2 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com