
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
| 实验操作步骤 | 实验现象 | 结论 |
| 在两支洁净的试管中分别加入2mL新制银氨溶液(或新制氢氧化铜),各滴入3滴(或0.5mL)乙醛和乙醇振荡,水浴加热(或加热)试管(3分) | 滴入乙醛的试管中有银镜(或红色沉淀)生成,而滴入乙醇的试管中无现象(1分) | 乙醛的还原性比乙醇强(1分) |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
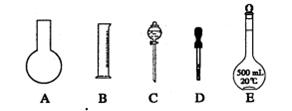
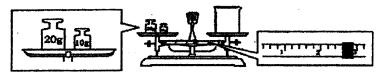
科目:高中化学 来源:不详 题型:单选题
| A.某常见气体的密度为1.8g/cm3 |
| B.某元素的原子半径是0.0160nm |
| C.某澄清石灰水的浓度是2.0mol/L |
| D.用广泛pH试纸测得某溶液的pH值为6.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
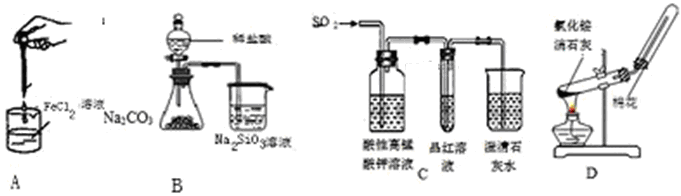
| A.制备氢氧化亚铁 | B.验证非金属性Cl >C >Si |
| C.检验二氧化硫中是否混有二氧化碳 | D.实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
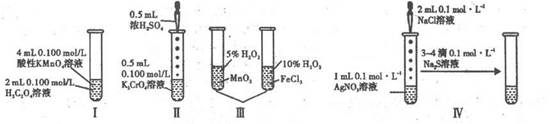
| A.实验I :反应开始时反应速率由慢变快,再变慢 |
| B.实验II :滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
| C.实验III:由该实验可以验证催化剂的催化效果 |
| D.实验IV:能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
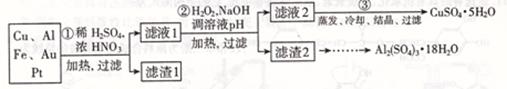
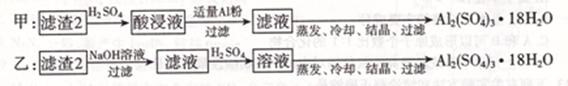
| 沉淀物 | Fe( OH)2 | Fe( OH)3 | Al( OH)3 | Cu( OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
 +I2= 2I-+S4O
+I2= 2I-+S4O
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
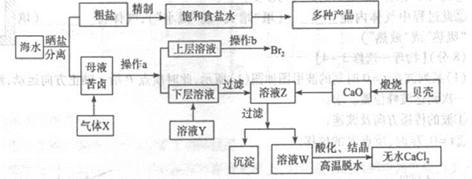
| A.盐酸 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.碳酸钠溶液,则加入试剂的顺序是(填编号)______ |
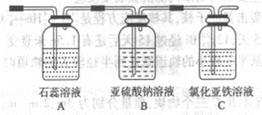
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.量筒 | B.酸式滴定管 | C.碱式滴定管 | D.容量瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com