
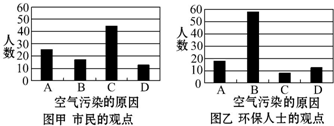
���� ��1����ͼ��֪��ͼһ��ʾ�˵��ؾ�����Ϊ������п�����Ⱦ������Ҫ��ԭ��ͼ����ʾ�˻�����ʿ��Ϊ��ɱ��ؿ�����Ⱦ������Ҫ��ԭ��
��2��������ʿ���ý����������йأ��������������ʷ�Ӧ���Դ������
��� �⣺��1����ͼ��֪��ͼһ��ʾ�˵��ؾ�����Ϊ������п�����Ⱦ������Ҫ��ԭ����Ȼͼһ��C��������࣬ͼ����ʾ�˻�����ʿ��Ϊ��ɱ��ؿ�����Ⱦ������Ҫ��ԭ��B��������࣬�ʴ�Ϊ��C��B��
��2��������ʿ���ý����������йأ������úȼ�����ɶ��������ð�ˮ���ո�����ʱ�Ļ�ѧ��Ӧ����ʽΪ2NH3+SO2+H2O�T��NH4��2SO3��
�ʴ�Ϊ��ȼ�պ���ú��SO2��2NH3+SO2+H2O�T��NH4��2SO3��
���� ���⿼�鳣���Ļ�����Ⱦ����������ȷͼ���е��ݺ�����ĺ��弰������γ��ǽ����Ĺؼ�����ȷ��ʶ������������Ȼ���е�ת����Ӱ�죬ע����˲���������̼�⣬����������������ŷŵ������еĶ��������ǿ�����һ����Ⱦ���壬����������ˮ�����Ĺ�ͬ�����£����γ����������꣬��Ŀ�ѶȲ���


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����ͬ��Ԫ�� | B�� | ����ͬλ�� | C�� | ����ͬ�ֺ��� | D�� | ����ͬ��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 CH3COO-��aq��+H+��aq����H=+0.3 kJ/mol��
CH3COO-��aq��+H+��aq����H=+0.3 kJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ı���������Ӧ���ת��������ƽ�ⳣ��Ҳһ������ | |
| B�� | �����£�V1L pH=12��NaOH��Һ��V2L pH=2��HA��Һ��ϣ������Һ�����ԣ���V1��V2 | |
| C�� | ��0.1mol•L-1 NaHCO3��Һ�У���������NaOH���壬Na+��CO32-������Ũ�Ⱦ����� | |
| D�� | ԭ�Ӿ�������Ӿ���������ˮ���ۻ�ʱ��ѧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
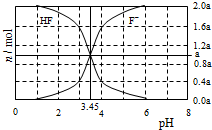 25��Cʱ����2a mol•L-1NaOH��Һ�ζ�1.0L2a mol•L-1�������Һ���õ����Һ��HF��Fһ�����ʵ�������ҺpH�ı仯��ϵ��ͼ��ʾ������˵����ȷ����
25��Cʱ����2a mol•L-1NaOH��Һ�ζ�1.0L2a mol•L-1�������Һ���õ����Һ��HF��Fһ�����ʵ�������ҺpH�ı仯��ϵ��ͼ��ʾ������˵����ȷ����| A�� | pH=3ʱ����Һ�У�c��Na+����c��Fһ�� | |
| B�� | c��Fһ����c��HF��ʱ����Һһ���ʼ��� | |
| C�� | pH=4ʱ����Һ�У�c��HF��+c��Na+��+c��H+��-c��OH-����2amol•L-1 | |
| D�� | pH=3.45ʱ��NaOH��Һǡ����HF��ȫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �Ȼ�����Һ�м��������ˮ���Ȼ�����Һ�м��������ˮ��Al3++3OH-�TAl��OH��3�� | |
| B�� | ����ͨ�������Һ�У�NH3+CH3COOH�TCH3COO+NH4+ | |
| C�� | �Ȼ�����Һ�м������ۣ�Fe+2FeCl3�T2Fe+3Cl- | |
| D�� | ̼����þ��Һ�м������ʯ��ˮ��Mg2++2HCO3-+Ca2++2OH-�TCaCO3��+2H2O+Mg��OH��2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
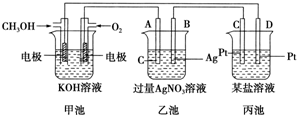
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com