
准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的C02全部用足量的澄清石灰水吸收,得到沉淀4g,则这种铁的氧化物为
A.Fe3O4 B.Fe203 C.FeO D.以上都不是
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸亚铁蓉易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。
现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:
Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶审加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为![]() 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣于燥后称重,剩余铁屑质量为![]() 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却气结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为![]() 。
。
回答下列问题:
(1)能够甩于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)实验中三次用到过滤操作,完成该操作的玻璃仪器有 。
步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·![]() H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论)。
。
查看答案和解析>>
科目:高中化学 来源:湖北省武汉市2010届高中毕业生四月调研测试理科综合(化学) 题型:填空题
硫酸亚铁蓉易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。
现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:
Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶审加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为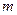 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣于燥后称重,剩余铁屑质量为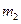 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却气结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为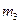 。
。
回答下列问题:
(1)能够甩于除去铁屑表面油污的试剂是 (填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
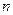 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:填空题
(14分,每空2分)
硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O
(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为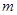 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·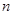 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com