
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
科目:高中化学 来源: 题型:

- 4 |
- 2 |
 ═□Mn2++□NO
═□Mn2++□NO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
B、用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O
| ||||
| C、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-═BaCO3↓+H2O | ||||
| D、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O══[Ag(NH3)2]++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaOCl2 |
| B、(NH4)2Fe(SO4)2 |
| C、BiONO3 |
| D、K3[Fe(CN)6] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、放出热量关系:a=92.4<b |
| B、N2的转化率:③>①>② |
| C、达平衡时氨气的体积分数:①>③ |
| D、三个容器内反应的平衡常数:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24 | B、40 | C、56 | D、65 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:1 |
| C、5:1 | D、7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
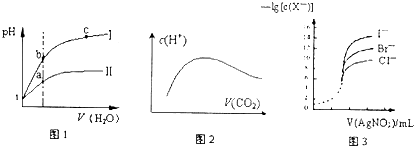
| A、图1表示同温度下,Ph=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C、如图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D、用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com